Chromatin-Forschung: Grants für Michael Robson
Lange bevor es Menschen auf der Erde gab, waren unsere Säugetiervorfahren – so legen es Forschungen nahe – nur in der Dunkelheit auf Nahrungssuche. Da die Dinosaurier den Tag beherrschten, konnten sich die frühen Säugetiere wahrscheinlich nur entwickeln, indem sie ihnen entgingen und nachts aktiv waren. Im Laufe der Zeit, als die Dinosaurier verschwanden und der Druck, sich zu verstecken, nachließ, entwickelten sich viele Säugetiere – auch die unserer eigenen Abstammungslinie – so, dass sie bei Tageslicht besser sehen konnten.
Einige Säugetiere allerdings, beispielsweise Mäuse, haben sich Reste unseres evolutionären Erbes bewahrt. Ihre Augen sind noch immer besser an das Sehen in der Dunkelheit angepasst. Für Dr. Michael Robson ist diese evolutionäre Divergenz Hauptanlass seiner Forschung: Er möchte entschlüsseln, wie Chromatin – der Komplex aus DNA, Proteinen und RNA, der sich im Kern eukaryontischer Zellen befindet – die Aktivität von Genen steuert.
Mit zwei neuen Grants – einem Preis der Deutschen Forschungsgemeinschaft (DFG) in Höhe von 449.125 Euro und einem Zuschuss des Human Frontier Science Program (HFSP) in Höhe von 1,5 Millionen Dollar, der zu gleichen Teilen auf vier kooperierende Labore aufgeteilt wird – untersucht das Team von Robson die Natur des Chromatins und geht der Frage nach, wie Abweichungen in dessen Struktur zu menschlichen Krankheiten wie Makuladegeneration oder Retinitis pigmentosa beitragen können.
Ein Erbe der Evolution
Robson macht sich dabei eine besondere Eigenschaft der Stäbchenzellen in der Netzhaut von Mäuseaugen zunutze. In Anlehnung an unsere evolutionäre Vergangenheit ist das Chromatin in diesen Zellen so organisiert, dass die Tiere im Dunkeln sehen können. Die aktive DNA, Euchromatin genannt, befindet sich am Rand der Stäbchen-Zellkerne, während das inaktive Chromatin, das Heterochromatin, dicht zusammengeballt in deren Mitte liegt.
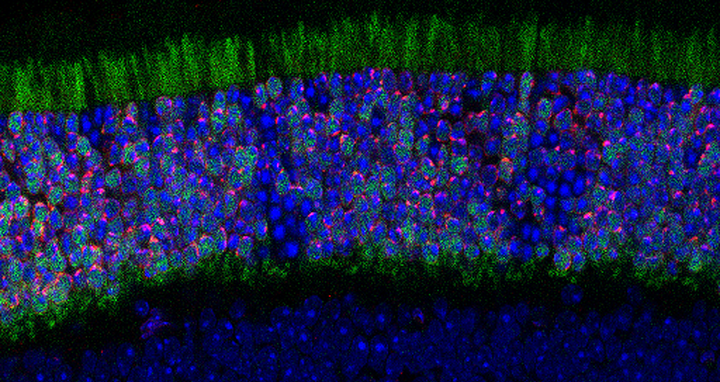
Netzhautgewebe im Querschnitt: Die Gene der Maus wurden so verändert, dass sie in den Stäbchen das Protein LBR bilden. In der obersten Schicht heftet LBR das Heterochromatin an den Rand des Zellkerns an und kehrt die für das nächtliche Sehen typische umgekehrte Kern-Architektur um zu einer konventionellen Architektur, die eher charakteristisch für Sehen bei Tageslicht ist (rot). Die Stäbchen ohne LBR weisen weiterhin die umgekehrte Kern-Architektur des nächtlichen Sehens auf (blau). Grün markiert ist das LBR-Gen.
Bei tagaktiven Säugetieren, auch beim Menschen, ist es genau umgekehrt: In ihren Stäbchen befindet sich inaktives, dicht gepacktes Heterochromatin am Rande des Zellkerns, während aktives Euchromatin in der Mitte schwimmt. Das Heterochromatin ist mit spezifischen Proteinen in der Kernmembran verankert.
Forschungsergebnisse deuten darauf hin, dass manche Krankheiten, die das Sehvermögen beeinträchtigen, womöglich durch eine Fehlregulation dieser Proteine entstehen.
Einige der Proteine sind bereits identifiziert. „Wir wissen bisher aber nicht, welches Protein welche Genomregionen an der Peripherie befestigt“, sagt Robson. Da Mäusen eine vergleichbare Interaktion in ihren Stäbchenzellen fehlt, wird das Robson-Labor gentechnische Verfahren einsetzen, um die Tiere mit bestimmten Proteinen auszustatten. Mithilfe der Einzelzellgenomik wollen er und sein Team im Anschluss erforschen, wie jedes Protein die Struktur des Chromatins und damit die Gentranskription reguliert.
Flüssig, viskös oder fest?
Mit dem HFSP-Grant, den sich Teams aus Deutschland, Großbritannien, den USA und Portugal teilen, möchte die Robson-Gruppe ein weiteres einzigartiges Merkmal der Mäuseaugen nutzen: Die Tiere kommen mit Stäbchen zur Welt, die zunächst wie bei anderen Säugetieren strukturiert sind und mit denen sie bei Tageslicht besser sehen. „Doch die Stäbchen verändern sich, noch bevor die Mäuse ihre Augen öffnen können, innerhalb von 48 Stunden“, erläutert Robson.
Dieser rasche Positionswechsel von Heterochromatin und Euchromatin in den Stäbchen ist ein seltenes Zeitfenster, in dem das Genom aktiv umgestaltet wird. Robson und seine Kolleg*innen wollen nun eine grundlegende Frage untersuchen: Wie verhält sich Chromatin physikalisch betrachtet? Hat es die Eigenschaften einer Flüssigkeit, eines Gels oder eines Feststoffs? „Wir können diesen Zeitpunkt, wenn sich das Chromatin im Zellkern bewegt, nutzen, um seine physikalischen Eigenschaften besser zu verstehen“, erklärt der Forscher. Denn diese beeinflussen, wie Gene an- und abgeschaltet werden.
Mithilfe moderner Bildgebung und Computermodellierung wird das Team simulieren, wie unterschiedliche physikalische Zustände – flüssig oder fest – die Bewegung der DNA während der Umstrukturierung vorhersagen. „Das ist eine Chance, die materielle Natur des Chromatins zu beschreiben“, sagt Robson. „Letztendlich erklärt uns das, wie es als zelluläre Maschine funktioniert.“
Text: Gunjan Sinha