Neue Isolation für enthüllte Nerven
Ohne die Myelin genannte Hülle würden elektrische Impulse entlang nackter Axone, dem biologischen Äquivalent eines nackten Drahtes, durch unser Nervensystem wandern. Dabei würde Energie verloren gehen und weiter entfernte Körperregionen würden die Signale der Nerven niemals erhalten. Die Evolution hat hierfür eine Lösung beschert, die jedem Elektroingenieur bekannt vorkäme: Isolatoren. Diese Funktion wird im Körper von Zellen wahrgenommen, die hohe Mengen an Myelin herstellen, einer Mischung aus Protein- und Fettmolekülen (Lipiden). Diese umwickeln als Hüllen die langen, drahtähnlichen Axone der Nervenzellen. Bei einer Reihe schwerwiegender Erkrankungen werden diese Hüllen zerstört, die Kommunikation unterbrochen, und dies führt zum Tod von Nervenzellen und schweren Funktionsstörungen in den betroffenen Menschen oder Tieren. In einem Kooperationsprojekt mit weiteren MDC-Forschungsgruppen hat das Labor von Prof. Carmen Birchmeier in Zellen ein Signalsystem entdeckt, welches die Produktion von Myelinproteinen aktivieren kann. Die Arbeit wurde vor kurzem in einer Ausgabe von Genes and Development veröffentlicht.
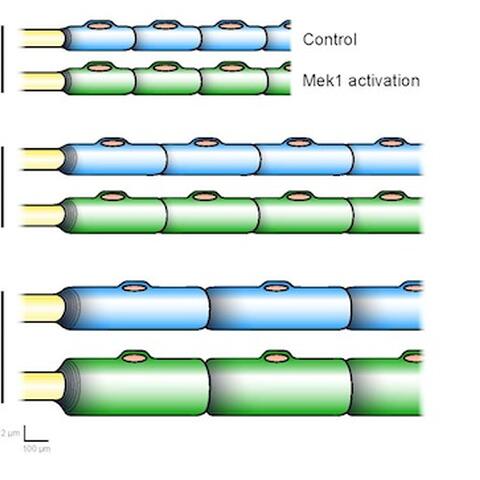
Myelinisierende Zellen (blau und grün) hüllen sich um die Axone (gelb), um Scheiden zu bilden, die als Isolatoren fungieren. Durch die Aktivierung von Mek1 wird die Myelinproduktion gesteigert und es entstehen verdickte Myelinscheiden (grün). Der Unterschied lässt sich am besten bei älteren Mäusen (P30) erkennen, bei denen die Myelinisierung in der Regel aufgrund normaler Alterungsprozesse langsamer wird. Tiere mit aktivem Mek1 produzieren weiter myelinhaltige Membranen.
Im peripheren Nervensystem (außerhalb von Gehirn und Rückenmark) produzieren spezialisierte Schwann-Zellen riesige Mengen der Myelin-haltigen Membran, und umwickeln damit Axone. Bei Mäusen beginnt dieser Prozess um die Geburt und dauert bis ins Erwachsenenalter, nimmt aber schon in der Adoleszenz ab. Zunächst werden durch axonale Signale Gene aktiviert, die für Myelinproteine und für lipidproduzierende Enzyme in Schwann-Zellen kodieren. Dadurch werden mRNA-Moleküle in großer Menge produziert; in einem zweiten Schritt werden mit Hilfe der mRNA Proteine hergestellt, d.h. die mRNA wird in Protein umgesetzt.
„Die Menge von Myelin, die die Zellen produzieren, muss genau kontrolliert werden“, so Prof. Birchmeier. „Axone haben unterschiedliche Durchmesser, und ihre Größe bestimmt die Dicke der Myelinscheide. Es ist einiges bekannt über die biochemischen Signale, die die Myelintranskription fördern oder blockieren, aber technische Grenzen haben uns bisher daran gehindert, einen genaueren Blick auf den zweiten Schritt, die Translation, zu werfen. Genau der wurde nun im laufenden Projekt unter die Lupe genommen.“
Die Forschungsgruppe von Prof. Matthias Selbach am MDC hat eine Methode zur Beobachtung der Zeiten und Geschwindigkeiten entwickelt, mit denen in Mäusen Proteine aus RNA synthetisiert werden. Die Methode basiert auf Pulsed SILAC (stabile Isotopenmarkierung mit Aminosäuren in Zellkultur), bei der Zellen nacheinander in zwei verschiedenen Wachstumsmedien gehalten werden. Das erste Medium enthält normale Formen von Aminosäuren, die Bausteine zur Herstellung von Proteinen. Im zweiten tragen einige Aminosäuren nichtradioaktive schwere Isotope. Diese Marker können mithilfe eines Massenspektrometers bestimmt werden. Wissenschaftler können damit Proteinproduktion in Zellen untersuchen und genau zwischen Molekülen unterscheiden, die im ersten oder zweiten Medium gebildet wurden. Erik McShane und Maria Sheean haben diese Pulsed-SILAC-Methode jetzt weiterentwickelt, um sie auch bei Mäusen und anderen Lebewesen anwenden zu können. Die Mäuse bekommen Milch oder Futter, die markierte Aminosäuren enthalten. Der Einbau der markierten Aminosäuren hat keine unerwünschten Auswirkungen auf die Gesundheit und gestattet den Wissenschaftlern, die Geschwindigkeiten, mit denen Proteine gebildet werden, zu beobachten.
Frühere Arbeiten aus dem Labor von Prof. Birchmeier hatten gezeigt, dass das Molekül Neuregulin-1 (Nrg-1) normalerweise die Transkription der Myelin-RNA auslöst. Nrg-1 aktiviert viele Signalwege. In der aktuellen Studie entdeckten Dr. Maria Sheean, Dr. Cyril Cheret und weitere Mitglieder der Forschungsgruppe von Prof. Carmen Birchmeier einen alternativen Signalweg, über den Zellen Myelinproduktion auslösen können. „Wir stimulierten den MAPK-Signalweg durch eine Form des Moleküls MAP kinase kinase 1 bzw. “„Mek1“, erläuterte Prof. Birchmeier. „Dieses Molekül aktiviert die Proteine Erk1, Erk2, S6 und eIF4E und führt zu einer kontinuierlichen Produktion neuer Myelinproteine und Enzyme, die Lipide produzieren. Mithilfe der SILAC-Methode erkannten wir, dass der Grund dafür nicht darin lag, dass die Zellen neue RNA produzieren. Vielmehr werde ein großer Vorrat an RNA, die zuvor ‚auf Halde gelegt‘ wurde, jetzt wieder in Proteine übersetzt.“
Die Wissenschaftler entdeckten, dass Schwann Zellen von Mäusen, die genetisch dahingehend verändert worden waren, dass sie eine überaktive Form von Mek1 produzierten, erhöhte Mengen von Myelin herstellten. Dies hatte zwei Effekte zur Folge: Der Rückgang der Myelin-Produktion, der normalerweise mit der Alterung einhergeht, wurde verhindert. Außerdem kam es zur Bildung sehr dicker Myelinscheiden, die in manchen Fällen sogar so dick waren, dass sie den Nerv zusammendrückten.
Mit diesen Erkenntnissen bietet sich in der Suche nach neuen Behandlungsmöglichkeiten für Krankheiten, die die Myelinscheiden betreffen, ein mögliches neues Target an. „Mek1DD aktiviert den MAPK-Signalweg und überwindet die Kontrollmechanismen, die normalerweise die Myelinisierung beenden“, erläuterte Prof. Carmen Birchmeier. „Das deutet darauf hin, dass die Produktion des Proteins durch die vorübergehende Aktivierung von MAPK neu stimuliert werden könnte, so dass Schwann-Zellen beschädigte Nerven wieder neu isolieren könnten.“
- Russ Hodge
Highlight Reference:
Sheean ME, McShane E, Cheret C, Walcher J, Müller T, Wulf-Goldenberg A, Hoelper S, Garratt AN, Krüger M, Rajewsky K, Meijer D, Birchmeier W, Lewin GR, Selbach M, Birchmeier C. Activation of MAPK overrides the termination of myelin growth and replaces Nrg1/ErbB3 signals during Schwann cell development and myelination. Genes Dev. 2014 Feb 1;28(3):290-303.
Link to the free full text of the paper