MDC-Forscher entdecken Molekül, das Verzweigung von Nervenbahnen steuert
Eine einzelne Nervenzelle kann durch die Verästelung ihres
faserartigen Fortsatzes (des Axons) Ausläufer in mehrere Zielgebiete entsenden
und dadurch Informationen zu mehreren Schaltstellen gleichzeitig übertragen.
Prinzipiell unterscheiden Neurobiologen zwei Arten axonaler Verzweigungen:
einerseits Verzweigungen des Wachstumskegels an der Spitze eines Axons und
andererseits das Aussprossen von Seitenästen (Kollateralen) aus dem Axonschaft.
Beide Formen axonaler Verzweigung lassen sich in
sensorischen Neuronen beobachten, die unter anderem Tast-, Schmerz-, und
Temperaturempfindungen vermitteln. Wenn die Axone dieser Neurone das Rückenmark
erreichen, gabelt sich zunächst ihr Wachstumskegel (Bifurkation) und sie
verzweigen sich in zwei, in entgegengesetzte Richtungen weiterwachsende Äste.
Später sprossen aus dem Schaft dieser Tochteraxone neue Äste, die in die graue
Substanz des Rückenmarks ziehen.
Dr. Hannes Schmidt und seinen Kollegen gelang es durch
Untersuchungen an sensorischen Neuronen ein Eiweißmolekül zu identifizieren, das
die Gabelung der Wachstumskegel sensorischer Axone steuert, das Peptidmolekül
CNP (die Abkürzung steht für C-type
natriuretic peptide). In transgenen Mäusen konnten die Wissenschaftler
zeigen, dass CNP genau dann im Rückenmark gebildet wird, wenn sensorische
Neurone einwachsen. Fehlt CNP, so findet auch keine Bifurkation mehr statt. Wie
elektrophysiologische Messungen ergaben, führt das zu einer verminderten
Reizübertragung im Rückenmark.
Die jetzt
veröffentlichten Ergebnisse ergänzen frühere Entdeckungen der Forschungsgruppe
von Prof. Rathjen: Verantwortlich für die Bifurkation sensorischer Axone ist
demzufolge eine Signalkaskade. Sie wird dadurch in Gang gesetzt, dass CNP an seinen
Rezeptor Npr2 (Natriuretic peptide receptor 2) auf der Oberfläche der Axone
bindet, was wiederum die Bildung des sekundären Botenstoffes cGMP auslöst. Dieser
Botenstoff aktiviert anschliessend die Proteinkinase cGKI (cGMP-dependent
protein kinase I), die eine ganze Reihe von Zielproteinen an- und abschalten
kann. Das Zytoskelett der Nervenzellen wird dadurch so verändert, dass sich ihr
Wachstumskegel in zwei Tochteraxone aufspaltet.
Als nächstes wollen die Wissenschaftler jetzt versuchen,
die Identität dieser Zielproteine zu entschlüsseln. Weiterführende Analysen
sollen klären, ob die cGMP-Signalkaskade gleichfalls die Verzweigung anderer
Axonsysteme steuert und ob dadurch die Schmerzempfindung beeinflusst wird.
*C-type natriuretic peptide (CNP) is a bifurcation factor for sensory
neurons
Author affiliation: Hannes Schmidta, Agne Stonkutea,
René Jüttnera, Doris Koeslingb, Andreas Friebeb,
Fritz G. Rathjena
a Department
of Developmental Neurobiology, MaxDelbrückCenter
for Molecular Medicine, Robert Rössle Str. 10, D-13092 Berlin
b
Institute for Pharmacology and Toxicology, Ruhr
UniversityBochum,
D-44780 Bochum
Correspondence to F.G. Rathjen: rathjen@mdc-berlin.de
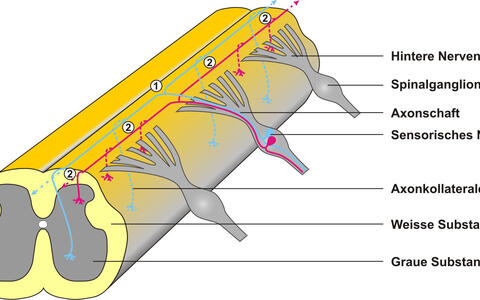
Schematische Darstellung einer sensorischen Nervenzelle. Beim Einwachsen des Axons des sensorischen Neurons in die Graue Substanz des Rückenmarks sind zwei Typen der Verzweigung zu beobachten: An der Dorsalwurzeleingangszone teilt sich der Axonschaft in zwei Äste (1), die auf der Oberfläche des Rückenmarks in entgegengesetzter Richtung weiterwachsen. Aus diesen Ästen sprossen danach an mehreren Stellen Kollaterale (2) und ermöglichen so die Übertragung eines Reizes auf mehrere Zielzellen. (Zeichnung: Hannes Schmidt / Copyright: MDC)
Die blaue Färbung zeigt das Verbreitungsgebiet von CNP in einem Mausembryo zwölfeinhalb Tage nach der Befruchtung. Durch gentechnische Veränderungen wurde in der abgebildeten Maus das normale Gen für CNP durch das lacZ-Gen ersetzt. In einer Farbreaktion kann dadurch die Expression von CNP im Gewebe sichtbar gemacht werden. (Foto: Hannes Schmidt / Copyright: MDC)
Dorsale Ansicht des Rückenmarks mit einzeln sichtbaren sensorischen Neuronen. A) Wildtyp mit durch Pfeile gekennzeichneten Bifurkationen und B) CNP-Knockout-Maus. (Foto: Hannes Schmidt / Copyright: MDC)
Barbara Bachtler
Pressestelle
Max-Delbrück-Centrum für Molekulare Medizin (MDC) Berlin-Buch
Robert-Rössle-Straße 10
13125 Berlin
Tel.: +49 (0) 30 94 06 - 38 96
Fax: +49 (0) 30 94 06 - 38 33
e-mail: presse@mdc-berlin.de
http://www.mdc-berlin.de/