Immuntherapie gegen Krebs: Wie Tumoren nachhaltiger angegriffen werden können
Seit Wissenschaftler entdeckt haben, dass Immunzellen prinzipiell Krebszellen abtöten können, versuchen sie, unser Immunsystem als Waffe gegen den Krebs zu nutzen. Das Prinzip dahinter ist einfach, die Umsetzung jedoch mitunter schwierig: In unserem Abwehrsystem gibt es bestimmte Immunzellen, die T-Zellen, die Eindringlinge in unseren Körper, wie Viren oder Bakterien, erkennen und eliminieren können. Auch Krebszellen können als abnormale Zellen identifiziert werden, bleiben aber meist verschont, da die T-Zellen sie als körpereigene Zellen betrachten.
Geschärfte T-Zellen können Tumoren erkennen
Bei der sogenannten T-Zellrezeptor-Gentherapie, richten Forscher daher die T-Zellen eines Patienten im Reagenzglas gegen die Krebszellen aus und geben sie dann dem Patienten wieder zurück. Dies hat sich als effektiv erwiesen: Forscher konnten in klinischen Studien zeigen, dass bei bestimmten Krebsarten in fortgeschrittenem Stadium bei der Hälfte oder mehr der geeigneten Patienten die Tumoren abgetötet werden konnten. Allerdings hielt der Erfolg oft nicht lange an, denn nach der Behandlung traten bei einem großen Teil der Patienten wieder Tumoren auf.
„Die Tumoren werden von den T-Zellen offenbar nicht mehr erkannt“, beschreibt Dr. Ana Textor das Problem. Sie ist Postdoc-Forscherin in der von Prof. Thomas Blankenstein geleiteten Forschungsgruppe „Molekulare Immunologie und Gentherapie“ am MDC und der Charité und Erstautorin der aktuellen Studie. „Wir wollten herausfinden, wie man erreichen kann, dass die Krebserkrankungen nach der Therapie seltener wieder auftreten“, sagt die Biologin.
T-Zellen patroullieren den Körper
Die einer Immunantwort zugrundeliegenden Prozesse sind kompliziert: T-Zellen identifizieren Krankheitserreger oder entartete Zellen anhand von sogenannten Antigenen. Dies sind fremde oder abnormale Proteine, zum Beispiel solche, die aufgrund einer Mutation in einer Krebszelle produziert werden. Diese Proteine werden in der Zelle in einer molekularen Maschine, dem Proteasom, in kleinere Fragmente zerlegt. Die Fragmente werden dann an die Oberfläche der Zelle gebracht und dort nach außen hin präsentiert.
Erst jetzt können die fremden oder abnormalen Zellen aufgespürt werden. Denn die T-Zellen patroullieren unablässig den Körper und tasten dabei die Oberflächen der Zellen nach Antigenen ab. Dazu nutzen sie die T-Zellrezeptoren, die die dort präsentierten Antigenfragmente erkennen können. Diese Teilbereiche der Antigene werden Epitope genannt. Jede T-Zelle ist hochspezifisch: Sie ist mit einem T-Zellrezeptor ausgerüstet, der nur ein bestimmtes Epitop erkennen kann.
Suche nach den besten Angriffspunkten
Die auf den Krebszellen präsentierten mutierten neuen Epitope stellen somit gute Angriffspunkte für die T-Zelltherapie dar. „Wir wollten nun insbesondere wissen, welche Parameter bei der Auswahl von Angriffspunkten für die T-Zellrezeptorgentherapie berücksicht werden sollten, um das Wiederauftreten von Tumoren zu verhindern“, erläutert Dr. Ana Textor.
Dazu verwendeten sie und ihre Kollegen ein transplantierbares Maus-Modell mit großen etablierten Tumoren für die T-Zellrezeptorgentherapie. Die Forscher wählten zwei sehr ähnliche Epitope eines bekannten Modell-Antigens aus, die beide spezifisch für Krebszellen sind. Sie werden auf der Oberfläche der Krebszellen in ähnlicher Menge präsentiert und von den T-Zellrezeptoren gut erkannt, was sie zu idealen Kandidaten für die Immuntherapie zu machen scheint.
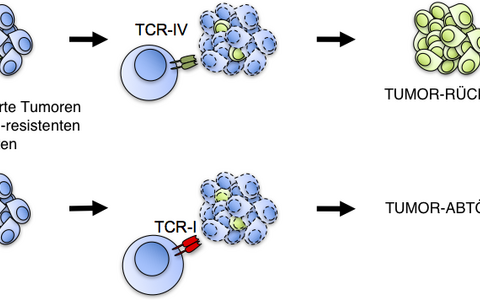
Die Forscher stellten im Reagenzglas T-Zellen von den Mäusen mit jeweils den T-Zellrezeptoren für diese beiden Epitope her und injizierten diese wieder in die Blutbahn der Tiere. Die Ergebnisse waren eindeutig: Während eine Art der T-Zellen den Tumor dauerhaft eliminierte, kam es nach der Behandlung mit der anderen T-Zell-Art nach anfänglicher Rückbildung zum Wiederauftreten des Tumors.
Ein Zellsignalprotein unter Verdacht
Die Forscher hatten einen weiteren Mitspieler im Immungeschehen dafür unter Verdacht: das Zytokin Interferon-gamma. Es wird von den T-Zellen gebildet, stimuliert dann die Krebszellen und hat im Allgemeinen eine aktivierende Wirkung auf die Immunabwehr.
Manche Epitope müssen in der Zelle nach dem Zurechtschneiden im Proteasom noch von einem Enzym namens ERAAP weiter bearbeitet werden, damit sie zur Zelloberfläche transportiert werden können. Dieses Enzym wird durch Interferon-gamma induziert. Die Forscher konnten zeigen, dass das Epitop, bei dem es zur Tumorabstoßung kam, keine Bearbeitung durch ERAAP benötigt, während das Epitop, bei dem Tumoren wieder auftraten, dies brauchte.
Genau das liefert die Erklärung für das Wiederauftreten des Tumors in diesem Modell: In den Primärtumoren hatten die meisten Zellen offenbar auf Interferon-gamma angesprochen, beide Epitope an der Zelloberfläche präsentiert und wurden von den T-Zellen angegriffen. Die Krebszellen in den wiederaufgetretenen Tumoren waren jedoch für das Interferon-gamma unempfänglich.
Tumorzellen, die nicht auf Interferon-gamma ansprechen, können entkommen
Als der Primärtumor abgetötet wurde, sind diese Zellen der einen Art von T-Zellen entwischt. Denn ohne das Interferon-gamma konnte das Epitop nicht in ausreichender Menge auf der Oberfläche präsentiert werden, und die T-Zellen konnten sie daher nicht erkennen. Aus diesen entkommenen Zellen konnte wieder ein neuer Tumor wachsen.
„Epitope, die keine Bearbeitung durch das Enzym ERAAP benötigen, sind daher vermutlich eine bessere Wahl für die Immuntherapie“, sagt Dr. Ana Textor. Da das Mausmodell gut etabliert und bekannt ist, dass viele Prozesse beim Menschen ähnlich sind, gehen die Forscher davon aus, dass sich dieses Ergebnis auf den Menschen übertragen lässt. Zudem wurde für HIV- und CMV-Infektionen gezeigt, dass es aufgrund einer ineffektiven Bearbeitung durch ERAAP zu einer Immunevasion kam.
Die neuen Erkenntnisse sind somit ein entscheidender Schritt zu einer erfolgreicheren Anwendung der T-Zellrezeptorgentherapie, denn sie legen nahe, dass die Auswahl von Angriffspunkten, die unabhängig von dem Interferon-gamma und ERAAP sind, das Wiederauftreten von Tumoren vermeiden könnte.
Die Studie wurde durch die Deutsche Forschungsgemeinschaft (Sonderforschungsbereich-Transregio, SFB-TR36) gefördert.
Ana Textor1, Karin Schmidt1,2, Peter-M Kloetzel2,3, Bianca Weißbrich4, Cynthia Perez1, Jehad Charo1, Kathleen Anders1, John Sidney5, Alessandro Sette5, Ton N.M. Schumacher6, Christin Keller2, Dirk H. Busch4, Ulrike Seifert2,7, Thomas Blankenstein1,3,8 (2016): „Preventing tumor escape by targeting a post-proteasomal trimming independent epitope.“ Journal of Experimental Medicine. doi:10.1084/jem.20160636
1Max-Delbrück-Center für Molekulare Medizin in der Helmholtz-Gemeinschaft, Berlin; 2Institut für Biochemie, Charité – Universitätsmedizin Berlin, Berlin; 3Berlin Institute of Health, Berlin; 4Institute for Medical Microbiology, Immunology and Hygiene, Technical University, München; 5La Jolla Institute for Allergy and Immunology, La Jolla, USA; 6The Division of Immunology, The Netherlands Cancer Institute, Amsterdam, Niederlande; 7Institute for Molecular and Clinical Immunology, Otto-von-Guericke- Universität, Magdeburg, Deutschland; 8Institute of Immunology, Charité – Universitätsmedizin Berlin.
Weiterführende Links
- Pressemitteilung zu der Publikation auf den Seiten des MDC, 04.10.2016
- Research Highlight zur T-Zelltherapie gegen Krebs, 06.04.2016
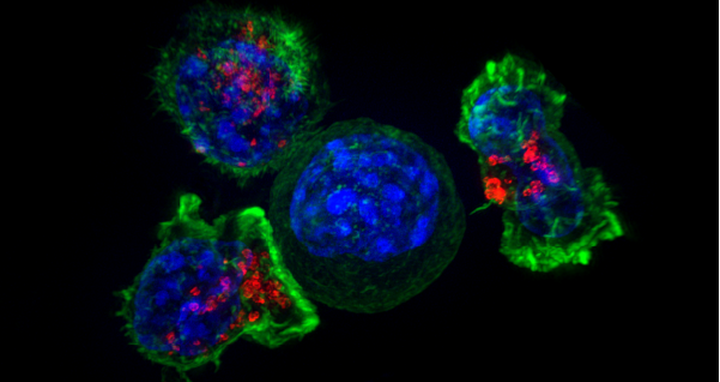
Beitragsbild: T-Zellen greifen eine Krebszelle an. Bild: Alex Ritter, Jennifer Lippincott Schwartz and Gillian Griffiths, National Institutes of Health, CC-BY-NC.