Neuer Therapieansatz für seltenen Blutkrebs in Aussicht
Das maligne Lymphom ist die häufigste Form von Lymphdrüsenkrebs und entsteht, wenn sich die zum Immunsystem gehörigen Lymphozyten unkontrolliert teilen. Man unterscheidet zwischen dem Hodgkin-Lymphom und den Non-Hodgkin-Lymphomen, zu denen auch das seltenere anaplastisch-großzellige Lymphom (ALCL) gehört. Das ALCL ist ein bösartiges T-Zell-Lymphom, von dem vor allem Kinder und junge Erwachsene betroffen sind. Sie bekommen als Standard eine Chemotherapie, jedoch treten häufig Rückfälle auf.
Wir konnten nachweisen, dass der Transkriptionsfaktor BATF3 und seine Zielgene eine Schlüsselrolle beim Wachstum der Tumorzellen einnehmen.
Eine Forschungsgruppe rund um Professor Olaf Merkel und Professor Lukas Kenner vom Klinischen Institut für Pathologie der Medizinischen Universität Wien bzw. der Veterinärmedizinischen Universität Wien in Kooperation mit der Forschungsgruppe von Professor Stephan Mathas vom Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC), der Charité – Universitätsmedizin Berlin sowie des Experimental and Clinical Research Center (ECRC) von MDC und Charité untersuchte nun die Rolle des Transkriptionsfaktors BATF3 bei ALCL.
Den Ausschlag dafür gab zum einen die Tatsache, dass dieser Faktor bei ALCL sehr stark exprimiert wird. Zum anderen verlangsamt sich das Wachstum von ALCL-Zellen, wenn BATF3 ausgeschaltet wird – ein Hinweis darauf, dass dieses Protein eine wichtige Rolle bei der Entstehung dieser Krankheit spielt. „Wir konnten nachweisen, dass der Transkriptionsfaktor BATF3 und seine Zielgene eine Schlüsselrolle beim Wachstum der Tumorzellen einnehmen“, fasst Co-Letztautor Stephan Mathas der Ergebnisse der Studie zusammen, die im Fachjournal „Nature Communications“ erschienen ist. „Dies könnte als Ansatzpunkt für die Entwicklung neuer Therapien dienen.“
Super-Enhancer-Region entdeckt
Bereits in früheren Kooperationsprojekten konnte die Gruppe um Stephan Mathas zeigen, dass einige AP-1-Transkriptionsfaktoren, darunter auch BATF3, bei dieser Blutkrebsart stark exprimiert wird. Angesichts der Bedeutung von BATF3 für die Krankheit gingen die Forscher*innen davon aus, dass es sich in einer Super-Enhancer-Region des Genoms befinden könnte. Super-Enhancer sind Bereiche im Genom, die von zentraler Bedeutung für die Genregulation und Zellidentität sind. Die zusammen mit dem Labor von Professor Thomas Look in Boston durchgeführte Genomanalyse bestätigte, dass BATF3 in allen analysierten Zelllinien, aber auch in primären ALCL-Patient*innenproben tatsächlich in einer Super-Enhancer-Region angesiedelt ist.
Darüber hinaus machten die Forscher*innen einen genomweiten Bindungstest für BATF3, einen BATF3 ChIP. Dabei stellten sie fest, dass BATF3 an seinen eigenen Promotor bindet und so eine positive Rückkopplungsschleife erzeugt. „Als wir die Gene beobachteten, deren Expression durch einen BATF3-Knockout verändert wurde, zeigten sich darunter mit am auffälligsten die Gene des Interleukin-2 (IL-2)-Rezeptor-Systems“, erklärt Olaf Merkel, „das veranlasste uns, die Mitglieder des trimeren IL-2-Rezeptors im Hinblick auf Expression und Funktion genau zu untersuchen.“
Grundlage für klinische Studie im Menschen
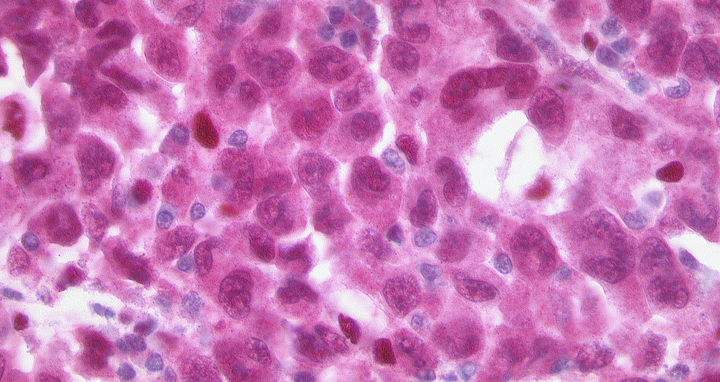
Repräsentative IHC-Bilder der jeweiligen IL-2R-Untereinheiten und H&E Färbung in 22 gemessenen ALCL, ALK+ Gewebeproben.
Die Forscher*innen stellten fest, dass alle drei Untereinheiten des IL-2-Rezeptor-Komplexes bei ALCL stark aktiviert werden und dass IL-2Rα und IL-2Rβ direkte Ziele von BATF3 sind. „IL-2 ist das wichtigste Interleukin, das nach der Aktivierung von T-Zellen freigesetzt wird“, sagt Merkel. „Wir konnten zeigen, dass IL-2 das Wachstum der ALCL-Tumorzellen fördert. Die Ansicht, dass IL-2 eine essenzielle Funktion für das ALCL-Wachstum hat, wird durch die hohe Aktivierung aller drei IL-2-Rezeptor-Untereinheiten bei mehr als 80 Prozent der ALCL-Patient*innen gestützt, was zusammen mit den funktionellen Analysen auf die hohe Bedeutung der IL-2-Signalübertragung in der ALCL hindeutet.“ Ein weiteres, eng verwandtes Zytokin, von dem bekannt ist, dass es zwei Untereinheiten mit dem IL-2-Rezeptor teilt, ist IL-15. Die Forscher konnten auch hier einen wachstumsfördernden Effekt auf die ALCL-Zellen zeigen.
Die Forscher*innen untersuchten außerdem den Effekt eines Antikörpers, der gegen eine IL-2-Rezeptor-Untereinheit gerichtet und an ein Zellgift gekoppelt ist, das ALCL-Zellen angreift. Bereits die einmalige Gabe dieses Antikörper-Zellgifts vermindert massiv das Tumorwachstum von ALCL-Zellen im Tiermodell. Dies könnte als Ansatzpunkt für die Entwicklung einer medikamentösen Therapie dienen und die Grundlage für klinische Studien im Menschen sein.
- Über die Studie
-
-
Die Studie wurde aus Mitteln des Horizon 2020 Marie Skłodowska-Curie Innovative Training Networks (ITN-ETN) der Europäischen Union für ein Projekt mit dem Titel „ALKATRAS“ (ALK Activation as a target of TRAnslational Science) gefördert.
Weitere Informationen
Literatur
Huan-Chang Liang et al. (2021): “Super-enhancer-based identification of a BATF3/ IL-2R−module reveals vulnerabilities in anaplastic large cell lymphoma”, Nature Communications, DOI: doi.org/10.1038/s41467-021-25379-9