Rivalität unter Geschwistern: Wie die Behandlung von B-Zell-Lymphomen seltene Tumorzellen begünstigen kann
Die Studie war von der Zeitschrift Nature angenommen worden und sollte innerhalb weniger Tage erscheinen. Klaus Rajewsky befand sich gerade auf dem Weg zu einem Seminar an der Washington University in St. Louis, um über die wissenschaftlichen Ergebnisse seiner Forschergruppe zu sprechen. Einiges deutete damals darauf hin, dass diese einen entscheidenenden Durchbruch in der Krebstherapie sogenannter B-Zellen-Lymphome darstellen könnten.
In seinem Labor in Harvard stand jedoch gerade ein Postdoc namens Stefano Casola kurz davor, die gesamte Angelegenheit zu Fall zu bringen. Rajewsky und Casola dämmerte nämlich, dass die Forschergruppe ein Kontrollexperiment vergessen hatten. Der Fachzeitschrift war dies gar nicht aufgefallen – doch der Lapsus bedeutete, dass eine wesentliche Annahme des Artikels nicht überprüft worden war. Rajewsky konnte dies nicht durchgehen lassen – Kontrolle musste sein.
Die schlechte Nachricht erreichte Rajewsky, als er gerade in St Louis landete: Das Kontrollexperiment war teilweise missglückt, und dies stellte die Resultate in Frage. Die Publikation der Arbeit wurde gestoppt. Nach dem entsprechenden Anruf musste Rajewsky seinen Vortrag, den er noch am selben Tag halten sollte, vollständig umkrempeln. Das Projekt hatte einen herben Rückschlag erlitten, und die Wissenschaftlerinnen und Wissenschaftler in Harvard konnten mit der Arbeit von vorne beginnen. Das Forschungsprojekt wurde schließlich unter der Leitung von Casola weitergeführt, als er 2006 seine eigene Forschergruppe am FIRC Institute of Molecular Oncology in Mailand gründete.
Heute – 15 Jahre nach seinem Beginn – ist das Projekt so weit, dass es in Nature publiziert wurde. Die Studie löst ein fundamentales Rätsel rund um B-Zell-Lymphome und liefert dazu warnende Hinweise für Krebstherapien.
BCR: Wie entscheidend sind sie wirklich?
Während seiner über 50 Jahre währenden wissenschaftlichen Karriere hat Klaus Rajewsky die Regulationsmechanismen des Immunsystems erforscht – zuerst an der Universität zu Köln, dann an der Harvard University, und nun am Max-Delbrück-Centrum für Molekulare Medizin (MDC). Es gibt nur wenige Dinge, die wirklich zweifelsfrei feststehen innerhalb eines Systems, in dem dutzende Zelltypen auf hochkomplexe Weise interagieren und so über Gesundheit und Krankheit entscheiden. Als grundlegendes Prinzip nahm man jedoch stets an, dass das Überleben von B-Zellen von einem bestimmten Molekül an ihren Oberflächen abhänge.
Diese B-Zell-Rezeptoren (BCR) sind eine Art von Antikörper, der von der Zelle produziert wird und anschließend mit ihrer Oberfläche verbunden bleibt. Bindet ein BCR an ein fremdes Antigen, so löst es Reaktionen in der Zelle aus, die eine Schlüsselrolle in der Immunabwehr spielen. Schnell beginnen manche Zellen dann, den Antikörper zu kopieren: Sie verwandeln sich gewissermaßen in Fabriken, die große Mengen des Antikörpers produzieren und in den Blutkreislauf entlassen. Auf diese Weise werden andere Immunzellen instruiert, den eindringenden Krankheitserreger zu erkennen und zu zerstören. Andere B-Zellen „erinnern“ sich an die Infektion, so dass der Körper beim nächsten Mal eine schnelle Immunantwort parat hat.
„Vor fünfzehn Jahren vertraten wir die Hypothese, dass B-Zell-Lympome B-Zell-Rezeptoren zum Überleben bräuchten. Schließlich entstehen sie aus B-Zellen entspringen und exprimieren B-Zell-Rezeptoren“, sagt Rajewsky. „Das sah nach einer Schwachstelle aus, die sich möglicherweise für die Therapie nutzen ließe.“
Jahrelang war diese Annahme die Grundlage für Therapieversuche, die auf die BCR abzielten oder auf die Mechanismen, mit denen diese Signale an andere Zellen übertragen. Doch trotz einiger ermutigender Ergebnisse hängt der Erfolg solcher Therapien von der Validität jener ursprünglichen Annahme ab. Und nun konnten die Forscherinnen und Forscher sowohl ihre Validität als auch ihre Limitationen endlich definieren – zumindest für einen bestimmten Lymphomtyp.
Wachstum trotz Verlusts des Rezeptoren
Die aktuelle Nature-Studie bezieht sich auf einen speziellen Typus von B-Zell-Lymphom, der aufgrund der Hyperaktivität eines „Onco-Proteins“ namens Myc entsteht. Casola konnte zeigen, dass die Lymphomzellen weiter wachsen, auch wenn sie den BCR verlieren. Allerdings sind sie dann nicht so „fit“ wie diejenigen, die ihre Rezeptoren behalten. Dieses Ergebnis könnte Konsequenzen für den klinischen Alltag haben. Wenn ein Tumor beide Zelltypen aufweist, überwuchern die Zellen mit BCR diejenigen, die keinen tragen. Wird diese Wettbewerbssituation jedoch aufgelöst – etwa weil ein Medikament die Zellen mit BCR eliminiert – dann können die ehemaligen Verlierer das Ruder übernehmen. Sie erzeugen Tumoren, die ganz genauso bösartig sind.
Um dieses Problem zu untersuchen, bauten die Wissenschaftler einen Schalter in diejenigen Gene ein, die die Fähigkeit der Zelle zur BCR-Produktion kontrollieren. Diese technologische Errungenschaft ist ebenfalls ein Ergebnis der Pionierarbeiten von Rajewsky und seinen Kolleginnen und Kollegen, die in den späten 80er Jahren begannen. Sie ist ein enormer Fortschritt gegenüber anderen Knock-Out-Methoden dar, bei denen Gene einfach “ausgeschaltet” wurden – denn Letzteres bedeutete, dass Moleküle in Embryonalzellen und damit im ganzen Organismus für dessen gesamte Lebensdauer eliminiert wurden. Solche Methoden machten es häufig unmöglich, die Rolle von Genen in erwachsenen Organismen zu erforschen. Denn vielen Molekülen kommen bereits früh im Leben wesentliche Funktionen zu. Schaltete man diese schon im Embryo aus, verhinderte dies oft von vornherein die normale Entwicklung eines Tieres.
Bedingtes Ausschalten hingegen erlaubte es Forscherinnen und Forschern, die Funktionen eines Gens in ganz bestimmten Geweben und zu definierten Zeitpunkten im Leben eines Tieres zu unterbinden. In der vorliegenden Studie konnten die Forscher auf diese Weise die BCR in etablierten Tumorzellen entfernen und damit den Einfluss des Rezeptors auf Zellbiologie und Zellfunktionen untersuchen.
Eine Neuverdrahtung des Tumorstoffwechsels
Mit Unterstützung von Stefan Kempa und Christin Zasada, die beide am MDC forschen, entdeckte Casola, dass der Verlust der BCR die Zellen dazu brachte, einen grundlegenden Aspekt ihres Metabolismus neu zu verdrahten, nämlich die Art und Weise, wie sie Energie aus Kohlenstoff gewinnen. Dies erklärte zumindest teilweise, warum diese Zellen im Vergleich mit ihren Wettbewerbern schlechter abschnitten: Es machte die Zellen sehr verwundbar, sobald ihnen Nährstoffe entzogen wurden. Die Forscher führten diese Empfindlichkeit auf die Aktivität eines anderen Moleküls namens GSK3β zurück. Dieses Protein befindet sich an einer wichtigen Schnittstelle zwischen verschiedenen Signalwegen, die das Wachstum dieses Typs von B-Zell-Lymphom kontrollieren.
“Diese Tumoren entstehen in Zellen, die ihre Produktion des c-Myc-Onkoproteinen nicht drosseln können, und daraus resultiert eine unkontrollierte Zellwucherung”, sagt Casola. “Dieses Wachstum wird wiederum durch eine substanzielle Umprogrammierung des Stoffwechsels bösartiger Zellen angeheizt.” Aber das Netzwerk von Genen, die von c-Myc kontrolliert werden, wird durch die Aktivität des GSK3β-Protein gedämpft, indem es ihr Wachstum bremst. Da Tumorzellen ohne BCR das Protein GSK3β produzieren, erklärt dies ihre geringere Reproduktionsrate. Infolgedessen unterliegen sie im Wettbewerb den Krebszellen mit Rezeptoren.
Der Zusammenhang zwischen GSK3β und Myc legte ein weiteres Experiment nahe: Was würde wohl passieren, wenn man die Aktivität von GSK3β in Zellen ohne Rezeptor senken würde? Als die Forscherinnen und Forscher die Aktivität des Moleküls in Lymphomzellen hemmten, konnten sie beobachten, dass die Myc-Funktionen sich verbesserten – was wiederum den dämpfenden Effekt auf den Zellstoffwechsel umkehrte. Dies stellte die Leistungsfähigkeit der bösartigen B-Zellen ohne BCR wieder her, und der Krebs konnte gedeihen.
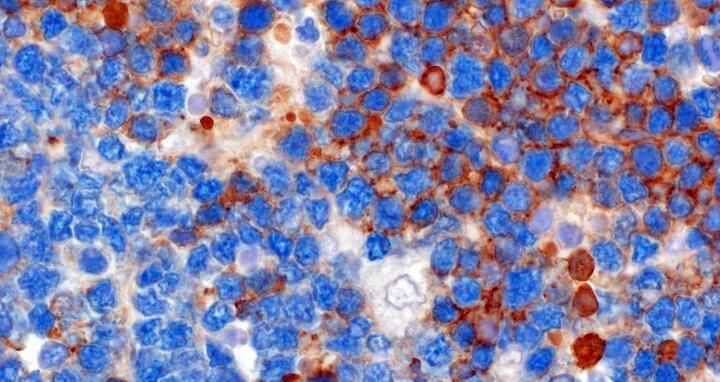
Casola und seine Kollegen berichten, dass menschliche Zellen sich ebenso verhalten wie diejenigen im Mausmodell. In rund einem Drittel der von ihnen analysierten menschlichen MYC-getriebenen Burkitt-Lymphomfälle fanden sie Bruchteile von Tumorzellen ohne BCR. “Dieser Befund sollte uns einen warnenden Hinweis darauf geben, dass eine Behandlung, die ausschließlich auf den BCR abzielt, das Auftreten von Rezidiven des Lymphoms befeuern könnte”, folgert Casola.
Diese Erkenntnisse legen es nahe, Anti-Lymphom-Behandlungsprotokolle zu entwerfen, in denen BCR-Hemmer mit Medikamenten wie Rapamycin und MEK-Kinase kombiniert werden, welche auf die Sekundärpopulation von Tumorzellen ohne BCR abzielen. “Dies macht es unverzichtbar, nach weitere Schwachstellen in denjenigen Zellen zu forschen, die keinen Rezeptor haben”, sagt Casola.
Varano G, Raffel S, Sormani M, Zanardi F, Lonardi S, Zasada C, Perucho L, Petrocelli V, Haake A, Lee AK, Bugatti M, Paul U, Van Anken E, Pasqualucci L, Rabadan R, Siebert R, Kempa S, Ponzoni M, Facchetti F, Rajewsky K, Casola S. (2017): „The B-cell receptor controls fitness of MYC-driven lymphoma cells via GSK3β inhibition.“ Nature. doi:10.1038/nature22353
Beitragsbild: Menschliche Zellen mit Burkitt-Lymphom können BCR aufweisen (braun), aber auch ohne überleben (blau).