Von der Faltkunst mitochondrialer Membranen
1966 schrieb die Wissenschaftlerin Lynn Margulis einen Aufsatz, der Zellbiologen, Evolutionsbiologen und ziemlich jeden im noch jungen Forschungsgebiet der Molekularbiologen gegen sie aufbringen sollte. Mit ihrer Arbeit ließ Margulis eine alte Hypothese wiederaufleben, die über den Ursprung der eukaryotischen Zellen spekuliert – also jenen Zellen, aus denen Menschen und andere Tiere, Pflanzen und Pilze bestehen.
Die junge Forscherin behauptete, vor etwa zwei Millionen Jahren hätten sich Bakterien in die Vorfahren unserer Zellen geschmuggelt und dort ein dauerhaftes Lager aufgeschlagen. Diese symbiotische Beziehung hätte sich als so vorteilhaft für beide Seiten erwiesen, dass sie in allen Nachkommen erhalten geblieben sei. Die Parasiten lebten bis heute in den Zellen weiter, so Margulis, und zwar als Mitochondrien. Diese Organellen besitzen ihr eigenes Genom und überleben nicht mehr außerhalb ihres Wirts, der sie mit allem Nötigen versorgt.
Erst zwölf Jahre später war es möglich, die Hypothese der Wissenschaftlerin durch den Vergleich mitochondrialer und bakterieller Gene zu überprüfen. Weitere Indizien folgten, und der symbiotische Ursprung der Mitochondrien fand Eingang in den Kanon der heutigen Lehrbücher. Viele Fragen zu ihren Funktionen bleiben jedoch offen: Ist ihre Struktur defekt, kommt es mitunter zu Krebs, neurologischen Erkrankungen und weiteren Krankheiten.
Die Forschungsgruppe von Prof. Oliver Daumke am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) löste nun zusammen mit Partnern aus Freiburg, Homburg und der Universität Halle-Wittenberg ein wichtiges Rätsel zur Struktur der Mitochondrien. In einem Artikel in der aktuellen Ausgabe des Fachjournals Nature Communications beschreiben sie, welche Rolle ein Protein beim Bau komplizierter Falten in der Mitochondrien-Membran spielt. So bildet sich ein Labyrinth aus präzise definierten Verflechtungen, die für die Funktion der Organelle unabdingbar sind.
Ein fingerartiges Gerüst
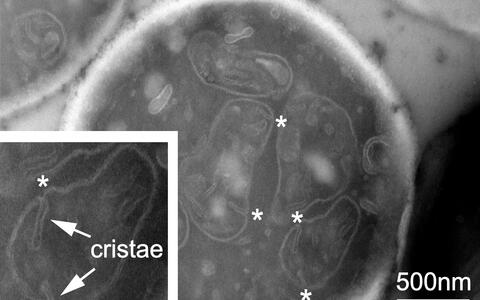
Die Membranen der Mitochondrien besitzen zwei Schichten. Die äußere weist zur Zellumgebung und ist glatt wie die Oberfläche einer Muschel. Die innere Membran dagegen ist mehrfach gefaltet und runzelig. Die zwei Membranen verhalten sich wie ein in einen Fäustling genähter Fingerhandschuh. Die Hand repräsentiert dabei wie das Innere des Organells, die Zwischenräume zwischen den Fingern „Cristae“ genannte Einstülpungen.
Diese langen, nach innen weisenden Falten tragen Proteine, die am Stoffwechsel und der Energieproduktion der Mitochondrien beteiligt sind. Die Cristae sind wahrscheinlich auch wichtig, wenn sich Mitochondrien teilen oder miteinander verschmelzen. Wenn ihre faltige Struktur gestört wird, besteht die Gefahr, dass die Organellen zusammenbrechen und giftige Substanzen an die Zelle abgeben.
Mit den Zwischenräumen zwischen den Fingern als Cristae sind die Fingerspitzen die crista junctions (CJ). Dort trifft die innere auf die äußere Membran, wo sich eine molekulare Maschine mit dem Namen MICOS befindet. Sie besteht aus mindestens sieben Proteinen und ist für die Formgebung der Membranen wichtig.
„Wir hatten Hinweise darauf, dass die zwei MICOS-Proteine Mic 10 und Mic60 besonders wichtig für die Faltung und die Bildung der Cristae sind“, sagt Erstautor Manuel Hessenberger. „Ohne diese Proteine kommt es zu tiefgreifenden Änderungen in der Architektur der Membran und der Organelle.“ Auch wenn in der Zelle zu viel Mic10 oder Mic60 vorliegen, komme es zu Deformationen.
Daumkes Team ist auf Strukturbiologie spezialisiert, das heißt, es will die Verbindung zwischen der räumlichen Struktur eines Moleküls und seinem Verhalten in der Zelle aufklären. Mic10 lagert sich bevorzugt zu bogenförmigen Gerüststrukturen an der Membran zusammen und hilft so, die scharfen Falze an den Rändern der Cristae zu bilden. Die Funktion von Mic60 ist dagegen unklar.
Scharfe und stabile Falze
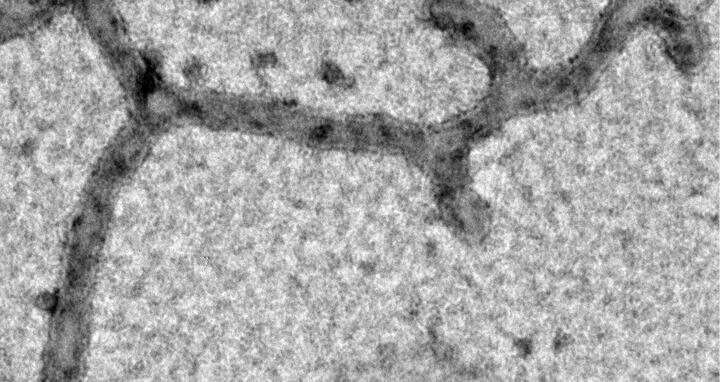
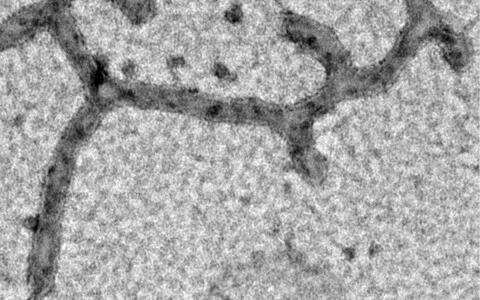
Im Experiment vermischte Manuel Hessenberger das Mic60-Protein mit gereinigten Lipiden, dem Hauptbestandteil von Membranen. Die Lipide organisierten sich zu langen schlauchartigen Formen und ähnelten damit Cristae. „Seine zentrale Rolle bei der Bildung von Cristae und der crista junctions übt Mic60 aus, indem es direkt an die Membran bindet und sie verformt“, sagt Hessenberger.
Auch die Region auf Mic60, die an die Membranen bindet, konnten die Forscherinnen und Forscher aufklären. Ist Mic60 nicht im MICOS-Komplex integriert, verbirgt es seine membranbindende Region. Das ändert sich, sobald eine weitere Komponente des MICOS-Komplexes an Mic60 bindet: ein Protein namens Mic19. Oliver Daumke erklärt: „Diese Kombination aus zwei Proteinen verankert Proteinkomplexe an den Kontaktstellen zwischen Cristae und äußerer Membran. Sobald sie dort ankommen, können sie die innere Membran verformen. Dabei bilden sie scharfe Falze und halten die gesamte Struktur zusammen.“
Mic60 positioniert sich so in der Membran, dass es die Krümmung stabilisiert. Daumke vergleicht das Protein mit einem Gummiband, das um benachbarte Fingerspitzen geschlungen wird und so deren Abstand zueinander bestimmt. Sobald dieser Mechanismus zusammenbricht, verliert die Struktur jedoch ihre Form und die Falten der Mitochondrienmembran fallen in sich zusammen.
Mitochondrien sind notorisch schwer zu untersuchen, denn ihre Gene lassen sich kaum modifizieren. Den Durchbruch schaffte Daumkes Team aus Forscherinnen und Forschern, indem sie den MICOS-Komplex im Reagenzglas nachbauten und die Interaktionen der Proteine mit der Membran analysierten. Die neue Studie erklärt zum ersten Mal die Aufgaben von Mic60 und Mic19 und wie ihre Struktur mit ihrer Funktion zusammenhängt.
Weiterführende Informationen
Manuel Hessenberger1,2, Ralf M. Zerbes3,4, Heike Rampelt3, Séverine Kunz1,5, Audrey H. Xavier1,2, Bettina Purfürst5, Hauke Lilie6, Nikolaus Pfanner3,7, Martin van der Laan8 & Oliver Daumke1,2: „Regulated membrane remodeling by Mic60 controls formation of mitochondrial crista junctions.“ Nature Communications. doi:10.1038/ncomms15258
1Department of Crystallography, Max Delbrück Center for Molecular Medicine, Berlin, Germany. 2Institute of Biochemistry, Freie Universität Berlin, Berlin, Germany. 3Institute of Biochemistry and Molecular Biology, ZBMZ, Faculty of Medicine, University of Freiburg, Freiburg, Germany. 4Faculty of Biology, University of Freiburg, Freiburg, Germany. 5Core Facility Electron Microscopy, Max Delbrück Center for Molecular Medicine, Berlin, Germany. 6Institute of Biochemistry and Biotechnology, Section of Protein Biochemistry, Martin Luther University Halle-Wittenberg, Halle/Saale, Germany. 7BIOSS Centre for Biological Signalling Studies, University of Freiburg, Freiburg, Germany. 8Medical Biochemistry and Molecular Biology, Center for Molecular Signaling, PZMS, Saarland University, Homburg, Germany.