Die Tricks der Lymphome
Aus der modernen Krebsbehandlung sind Immuntherapien nicht mehr wegzudenken. Besonders erfolgreich sind sie als Antikörpertherapien zum Beispiel bei Morbus Hodgkin, einer bösartigen Erkrankung des Lymphsystems. Bei aggressiven Non-Hodgkin-Lymphomen hingegen versagen vergleichbare Ansätze, bei denen das Immunsystem mit unterschiedlichen Strategien dazu gebracht wird, die Tumorzellen anzugreifen.
Zerstörte Architektur der Lymphknoten
In Versuchen mit Mäusen und menschlichem Tumorgewebe konnten wir zeigen, dass die Krebszellen die sensible Architektur in den Lymphknoten zerstören.
Die wahrscheinliche Ursache für dieses Versagen hat jetzt ein Team um Dr. Armin Rehm, den Leiter der Arbeitsgruppe „Translationale Tumorimmunologie“ am Berliner Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC), aufgespürt. „In Versuchen mit Mäusen und menschlichem Tumorgewebe konnten wir zeigen, dass die Krebszellen die sensible Architektur in den Lymphknoten zerstören“, erläutert der Erstautor der „Cell Reports“-Studie, Dr. Lutz Menzel, aus der Arbeitsgruppe von Rehm.
Dies führe schlussendlich dazu, dass eine Gruppe großer Blutgefäße, die hochendothelialen Venolen, eine ihrer wichtigsten Funktionen verliere. „Ohne diese intakten Gefäße können die Immunzellen auf ihrer Suche nach Tumor-Merkmalen nicht in die Lymphknoten einwandern“, sagt Menzel. Mehrere Teams des MDC waren an der von der Deutschen Krebshilfe geförderten Studie beteiligt, unter anderen die von Dr. Uta Höpken geleitete Arbeitsgruppe „Mikroumgebung als Regulator bei Autoimmunität und Krebs“.
Identische Befunde bei Mäusen und Menschen
„Aus einer früheren Studie wussten wir, dass aggressive Lymphome wie beispielsweise das diffus-großzellige B-Zell-Non-Hodgkin-Lymphom das Wachstum kapillarähnlicher kleiner Gefäße in den Lymphknoten anregen“, sagt Rehm. Auf diese Weise stellen die Tumorzellen sicher, dass sie während ihres schnellen Wachstums optimal mit Nährstoffen versorgt werden. „Gleichzeitig zeigten uns mikroskopische Untersuchungen, dass in den befallenen Lymphknoten nur sehr wenige Blutgefäße mit großem Durchmesser zu finden waren“, sagt Rehm. Die Befunde in Mäusen seien identisch zu denen bei Menschen mit aggressiven Lymphomen gewesen.
In ihrer aktuellen Studie haben die Forschenden zunächst an Mäusen untersucht, wie es zum Verlust der hochendothelialen Venolen kommt, durch den sich die Lymphome dem Angriff des zellulären Immunsystems entziehen. „Wir haben eine komplizierte Kaskade von Veränderungen entdeckt, bei der unter anderem Gerüststrukturen im Lymphknoten zerstört werden“, erklärt Menzel. „Dadurch ändern sich die Druck- und Volumenverhältnisse, die beide Einfluss auf die Genexpression haben.“
Dies führe letztendlich dazu, dass sich die hochendothelialen Venolen in ganz normale Blutgefäße umwandeln, über die Immunzellen keinen Zugang mehr zu den Krebszellen haben. Die Beobachtungen konnte das Team anschließend im menschlichen Krebsgewebe bestätigen. Zur Validierung der Ergebnisse dienten fast 80 Gewebeproben von Patient*innen mit einem aggressiven Non-Hodgkin-Lymphom.
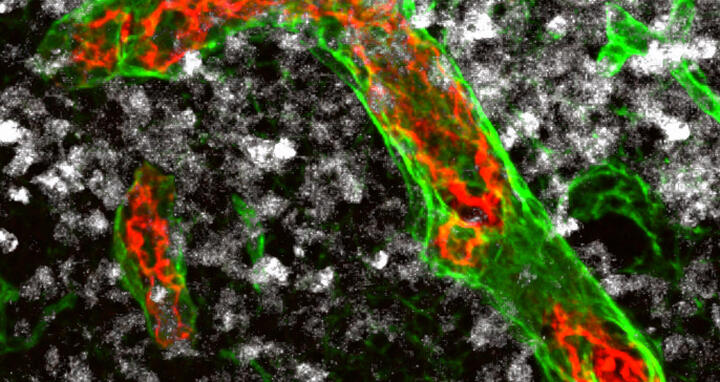
Über besonders große Blutgefäße, die hochendothelialen Venolen (im Bild rot-grün), können Immunzellen in die Lymphknoten einwandern und vorhandene Tumorzellen (weiß) zerstören. Bei aggressiven Non-Hodgkin-Lymphomen werden diese Gefäße nach und nach umgebaut. Wahrscheinlich ist das der Grund, weshalb zellbasierte Immuntherapien in derartigen Fällen bislang nicht wirken.
Die Krebszellen schaffen sich geschützte Nischen
Unsere Studie liefert nun tiefere Einblicke in die Methoden, mit denen sich die Tumorzellen ihre geschützten Nischen in Lymphknoten schaffen.
„Viele Tumorarten nutzen Strategien, um einem Angriff des Immunsystems zu entkommen“, sagt Rehm. Zum Beispiel entwickeln die Krebszellen bestimmte Oberflächenmoleküle oder produzieren Botenstoffe, die Immunzellen ausbremsen. Wie sich Lymphome während ihres Wachstums vor der Körperabwehr schützen, war bisher nur wenig erforscht. „Unsere Studie liefert nun tiefere Einblicke in die Methoden, mit denen sich die Tumorzellen ihre geschützten Nischen in Lymphknoten schaffen“, sagt Rehm.
„Besonders für die Krebsimmuntherapie ist es von entscheidender Bedeutung, die Gegebenheiten der Mikroumgebung des Tumors zu kennen“, ergänzt Menzel. „Nur so lassen sich Strategien entwickeln, mit denen zum Beispiel therapeutische T-Zellen den Tumor erreichen, um ihn dort direkt bekämpfen zu können.“
Einwanderung der Immunzellen erleichtern
Mit den neuen Erkenntnissen möchte das Team jetzt gezielte Maßnahmen entwickeln, die den Prozess des Verschwindens der hochendothelialen Venolen aufhalten oder sogar rückgängig machen. „Wir versuchen zum Beispiel, mithilfe verschiedener Medikamente die Gefäße im Lymphknoten gezielt zu verändern“, sagt Rehm. Dadurch wolle man die Einwanderung von Immunzellen erleichtern und die Abschirmung der Tumorzellen in ihrer Nische verhindern. Auf diese Weise, so hoffen die Forscher, könnten immuntherapeutische Ansätze wie zum Beispiel die CAR-T-Zell-Therapie auch bei aggressiven Non-Hodgkin-Lymphomen effizienter werden.
Text: Anke Brodmerkel
Weiterführende Informationen
Literatur
Lutz Menzel et al. (2021): „Lymphocyte access to lymphoma is impaired by high endothelial venule regression“. Cell Reports, DOI: 10.1016/j.celrep.2021.109878
Bild zum Download
Über besonders große Blutgefäße, die hochendothelialen Venolen (im Bild rot-grün), können Immunzellen in die Lymphknoten einwandern und vorhandene Tumorzellen (weiß) zerstören. Bei aggressiven Non-Hodgkin-Lymphomen werden diese Gefäße nach und nach umgebaut. Wahrscheinlich ist das der Grund, weshalb zellbasierte Immuntherapien in derartigen Fällen bislang nicht wirken. Foto: AG Rehm, MDC
Kontakte
Dr. Armin Rehm
Leiter der Arbeitsgruppe „Translationale Tumorimmunologie“
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 30 9406-3817
arehm@mdc-berlin.de
Jana Schlütter
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 30 9406-2121
jana.schluetter@mdc-berlin.de oder presse@mdc-berlin.de
- Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin. www.mdc-berlin.de