Ein möglicher Wirkstoff gegen Präeklampsie
Meist geht es nach der 20. Schwangerschaftswoche los: Plötzlich leiden die betroffenen Frauen an Bluthochdruck. Mit dem Urin scheiden sie ungewöhnlich viel Eiweiß aus (Proteinurie) – als Zeichen, dass die kleinen Gefäße in der Niere geschädigt werden. Zudem kann es zu lebensbedrohlichen Schädigungen der Leber und des Knochenmarks kommen. Das ungeborene Baby wird zudem nicht mehr ausreichend versorgt, wodurch sein Wachstum und seine Entwicklung gestört sein können. Rund fünf Prozent aller schwangeren Frauen in den westlichen Ländern erkranken an dieser Schwangerschaftsvergiftung, der Präeklampsie.
Nadine Haase wertet Mikroskopbilder am PC aus.
„Die Präeklampsie ist hierzulande die häufigste mit einer Schwangerschaft verbundene Krankheit, an der Frauen selbst bei uns heute noch vereinzelt sterben, und zudem die häufigste Ursache einer Frühgeburt, manchmal bereits zwischen der 24. und 30. Schwangerschaftswoche“, sagt Dr. Nadine Haase vom Experimental and Clinical Research Center (ECRC), einer gemeinsamen Einrichtung des Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) und der Charité – Universitätsmedizin Berlin. Haase ist die Erstautorin der aktuellen Studie zur Präeklampsie, die im „Journal of Clinical Investigation“ veröffentlicht ist. Sie forscht in der Arbeitsgruppe „Hypertonie-vermittelter Endorganschaden“ von Professor Dominik Müller und Professor Ralf Dechend, dem Seniorautor der Publikation.
Bislang ist die Krankheit nicht behandelbar
Medikamente gegen die Präeklampsie gibt es bisher nicht. „Man weiß zwar, dass das körpereigene Renin-Angiotensin-Aldosteron-System, das den Blutdruck sowie den Wasser- und Elektrolythaushalt reguliert, bei der Krankheit gestört ist“, sagt Haase. „Doch die bisher verfügbaren Wirkstoffe, die in dieses RAAS-System eingreifen, dürfen Schwangere nicht einnehmen. Denn sie können das Ungeborene, insbesondere deren Nierenentwicklung schädigen.“ Und andere Blutdrucksenker wie beispielsweise Methyldopa wirken bei der Präeklampsie kaum. „Oft gibt es dann keine andere Möglichkeit als eine vorzeitige Entbindung, die extrem Frühgeborene häufig gar nicht oder nur mit Behinderungen überleben“, sagt Haase.
Gemeinsam mit Kolleginnen und Kollegen aus Berlin, Essen, Hamburg und Jackson, Mississippi, sowie einem Team des medizinischen Forschungsunternehmens Alnylam Pharmaceuticals mit Hauptsitz in Cambridge, Massachusetts, hat sich Haase daher auf die Suche nach effektiveren Medikamenten gegen die Präeklampsie gemacht. Die Forscher*innen wollten herausfinden, ob von der Firma Alnylam entwickelte siRNA-Moleküle (small interfering RNA, auf Deutsch kleine eingreifende RNA) die Symptome der Schwangerschaftserkrankung lindern können, ohne das Ungeborene zu schädigen. „Die von uns verwendete siRNA senkt in der Leber die Produktion des Hormons Angiotensinogen, kurz Agt. Das ist eine Vorstufe des Angiotensin. Somit wirkt die siRNA regulierend auf das RAAS-System“, erläutert Haase. Alnylam hat dieses Wirkprinzip bereits erfolgreich bei anderen Erkrankungen des Menschen eingesetzt.
Mitglieder der Arbeitsgruppe Müller/Dechend, die am Thema Präeklampsie arbeiten.
Zwei Tiermodelle der Präeklampsie
Haase und ihre Kolleg*innen testeten die siRNA an zwei Tiermodellen. Zum einen nutzte das Team ein Modell, bei dem die weiblichen Ratten genetisch so verändert sind, dass sie menschliches Agt herstellen. Diese Tiere kreuzten die Forscherinnen und Forscher mit männlichen Ratten, die humanes Renin produzieren. Ein solches Vorgehen führt zu einer Überaktivität des RAAS-Systems mit entsprechenden Symptomen einer Präeklampsie während der Trächtigkeit weiblicher Tiere.
Für das andere, in den USA entwickelte Modell namens RUPP (Reduced Uteroplacental Perfusion Pressure) setzten die Forscher*innen trächtigen Tieren Clips ein, mit denen der Blutfluss in der Plazenta verringert wird. Die Feten der Tiere waren dadurch unterversorgt. Zudem entwickelten die per Clip behandelten mütterlichen Ratten – ebenso wie die genetisch modifizierten Tiere – Bluthochdruck und Proteinurie, wenngleich in geringerem Ausmaß. Auch zwei klinische Biomarker PLGF und sFLT1, die bei Schwangeren zur Diagnose einer Präeklampsie bestimmt werden, waren bei den Tieren verändert.
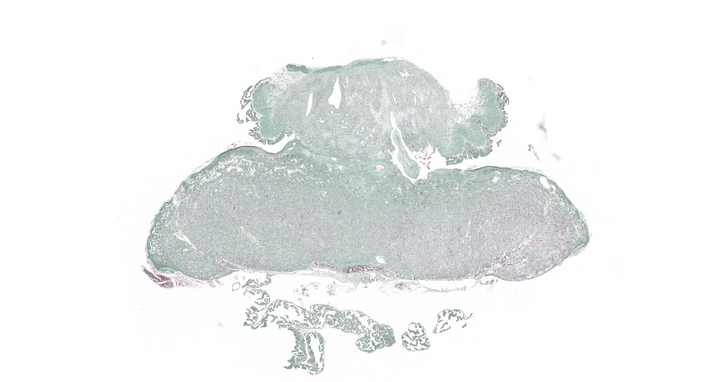
Histologisches Bild einer Rattenplazenta: MDC-Forschende analysierten mit Hilfe dieses Bildes u.a. die Spiralaterien, um Rückschlüsse auf die Versorgung des Fötus zu gewinnen.
Der Blutdruck sank, die Feten wuchsen
Für ihren Therapieversuch spritzten die Wissenschaftler*innen den Ratten die siRNA unter die Haut. Zuvor hatten sie die Moleküle chemisch so verändert, dass sie nur in der Leber wirken – also dort, wo das Hormon Agt gebildet wird. „Wie erhofft konnten wir beobachten, dass die Symptome der Präeklampsie bei den behandelten Tieren zurückgingen, und zwar in beiden Modellen“, sagt Haase. „Ihr Blutdruck sank und die Proteinurie verschwand.“ Das Verhältnis der Biomarker PLGF und sFLT-1 normalisierte sich ebenfalls. Infolgedessen wurden auch die Nachkommen im Mutterleib wieder besser versorgt.
Die Entwicklung eines RAAS-Blockers, der die Plazenta nicht überwindet und somit das Kind auch nicht schädigt, ist eine der großen Herausforderungen in der Geburtsmedizin.
Darüber hinaus habe man zeigen können, dass die siRNA-Moleküle tatsächlich nur in der Leber der Ratten die Herstellung des Hormons Agt blockieren, berichtet Haase. In der Plazenta war die siRNA nicht nachweisbar. Zudem untersuchten die Forscher*innen, ob sich die Behandlung der mütterlichen Tiere bei den Nachkommen auf die Entwicklung der Organe, zum Beispiel des Gehirns, der Lunge, des Herzens und der Niere, ausgewirkt hatte. „Wir fanden weder bei den ungeborenen Ratten noch bei den Tieren, die zur Welt gekommenen waren, irgendwelche negative Folgen“, sagt Haase. Die Therapie mit siRNA sei demnach anscheinend zumindest bei Tieren sicher.
Eine erste Studie mit Schwangeren
„Mit unserer Studie haben wir die erforderlichen Daten vorgelegt, um nun den nächsten Schritt in Richtung einer klinischen Studie zu gehen“, sagt Haase. Aber es bedarf auch noch weiterer Grundlagenforschung. „Die Entwicklung eines RAAS-Blockers, der die Plazenta nicht überwindet und somit das Kind auch nicht schädigt, ist eine der großen Herausforderungen in der Geburtsmedizin“, sagt der Seniorautor der Studie, Ralf Dechend. Das US-Unternehmen Alnylam plane nun einen ersten Therapieversuch mit schwangeren Frauen, bei der er als beratender Mediziner beteiligt sein werde. Haase hingegen denkt bereits über eine weitere präklinische Studie nach, bei der sie die Effekte eines Peptids – eines kleinen Eiweißmoleküls – zur Behandlung der Präeklampsie untersuchen möchte.
Text: Anke Brodmerkel
Weiterführende Informationen
- MDC Pressemitteilung: Präeklampsie wird durch eine Überdosis Genaktivität ausgelöst
- MDC Pressemitteilung: Präeklampsie: Entzündung der Plazenta stört Versorgung des Kindes
Literatur
Haase, Nadine et al. (2020): ”RNA interference therapeutics targeting angiotensinogen ameliorate preeclamptic phenotype in rodent models”, Journal of Clinical Investigation, DOI: 10.1172/JCI99417
Downloads
- Histologisches Bild einer Rattenplazenta: Forschende analysierten mit Hilfe dieses Bildes u.a. die Spiralarterien um Rückschlüsse auf die Versorgung des Fötus zu gewinnen. Foto: Nadine Haase, MDC
- Nadine Haase wertet Mikroskopbilder am PC aus. Foto: Markus Altmann
- Mitglieder der Arbeitsgruppe Müller/Dechend, die am Thema Präeklampsie arbeiten. Foto: Florian Herse, MDC
Kontakte
Dr. Nadine Haase
Wissenschaftlerin in der Arbeitsgruppe Müller/Dechend
Experimental and Clinical Research Center (ECRC) und Max-Delbrück-Centrum für Molekulare Medizin (MDC)
nadine.haase@mdc-berlin.de
Christina Anders
Redakteurin, Kommunikationsabteilung
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 (0)30 9406 2118
christina.anders@mdc-berlin.de
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.