Lungenschäden bei COVID-19-Erkrankungen verstehen
Seit eineinhalb Jahren versuchen Forschende auf der ganzen Welt, die durch das Coronavirus SARS-CoV-2 verursachte Erkrankung COVID-19 zu verstehen. Bis heute gibt es nahezu keine Medikamente zur Behandlung der Krankheit, die zu akutem Lungenversagen führen und neben der Lunge weitere Organe und Organsysteme schädigen kann. Eine der Hürden: COVID-19 wird unter anderem durch eine fehlgeleitete, mitunter überschießende Reaktion des körpereigenen Immunsystems verursacht. Um therapeutische Angriffspunkte zu finden, ist es notwendig, im Detail zu verstehen, wie und wo genau welche nachteiligen Prozesse im Körper ausgelöst werden. Die patientenzentrierte Forschung stößt hierbei an Grenzen. Vor allem wenn es darum geht, in der frühen Phase der Infektion Krankheitsmechanismen zu untersuchen. Biomaterial als Grundlage für Studien ist in der Regel erst nach Aufnahme in einem Krankenhaus zugänglich. Bei leichten oder mittelschweren Verläufen, verbunden mit einer Lungenentzündung, kann meist gar kein Gewebe aus der Lunge gewonnen werden – zu hoch wäre das Risiko für akut Erkrankte. Was bleibt, ist die Analyse von Zellgewebe nach dem Tod von COVID-19-Patient*innen.
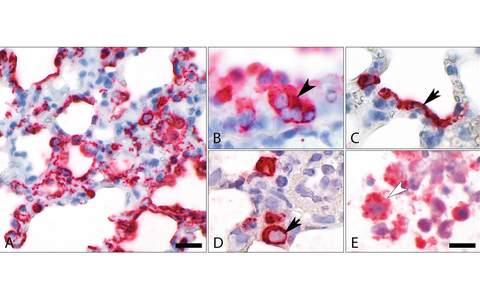
Einblick in infiziertes Lungengewebe (Abb. A). Schon am zweiten Tag befällt SARS-CoV-2, rot markiert, fast alle Bereiche der Lunge. Nachteilig für die Lungenfunktion: Sowohl die auskleidenden Zellen der Atemwege (B, Pfeilspitze) als auch die für den Gasaustausch zuständigen Zellen der Lungenbläschen (Pneumozyten Typ I und II – Pfeil in C und D) werden durch das Virus befallen und zerstört. In den Fresszellen der Lunge, den Makrophagen, lassen sich Viruspartikel in großer Zahl nachweisen (E, Pfeilspitze). Balken: B = 50 µm, C - E = 20 µm
Anhand verfügbarer Patientenproben konnte das Team um Professor Martin Witzenrath, Stellvertretender Direktor der Medizinischen Klinik mit Schwerpunkt Infektiologie und Pneumologie der Charité – Universitätsmedizin Berlin, wertvolle Informationen über Mechanismen und Verlauf der Erkrankung gewinnen. Um darüber hinaus Lungenareale zu untersuchen, die sich bei Patient*innen nicht ohne Weiteres betrachten lassen, und um Einblicke in die Frühphase der Erkrankung zu erhalten, war das Forschungsteam auf der Suche nach einem geeigneten Modell. In der internationalen COVID-19-Forschung wie auch bei der Erforschung des SARS-CoV 1 haben sich Hamstermodelle als aufschlussreich erwiesen. „Wir wollten wissen, ob die Modelle zur Entwicklung neuer Therapieansätze herangezogen werden können und haben versucht, Erkenntnisse aus Proben von Patientinnen und Patienten darin wiederzufinden. Das hat erstaunlich gut funktioniert“, sagt Witzenrath, Co-Letztautor der Studie, die in „Nature Communications“ erschienen ist. „Unser Interesse galt dabei insbesondere den Endothelzellen der Lunge, also der Barriere, die die Blutgefäße auskleidet. Diese verliert bei schwerem COVID-19 an Funktion, wodurch es schlussendlich zum Lungenversagen kommt.“
Goldhamster ist wichtigstes Tiermodell für COVID-19
Dr. Emanuel Wyler in seinem Labor am BIMSB
Gemeinsam mit Forschenden am Berliner Institut für Medizinische Systembiologie (BIMSB) des Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC), Virologen und Tiermedizinern der Freien Universität sowie Datenexperten des Berlin Institute of Health (BIH) in der Charité haben die Wissenschaftler*innen in ihrer aktuellen Arbeit eine genaue Charakterisierung der SARS-CoV-2-Infektion im Tiermodell vorgenommen und diese mit Datensätzen aus Proben von Patient*innen untermauert. Die Analyse soll das derzeit wichtigste nicht transgene Modell für COVID-19, den Goldhamster, zur Entwicklung von Therapien nutzbar machen. Hamster infizieren sich mit denselben Virusvarianten wie Menschen. Auch entwickeln sie ähnliche Krankheitssymptome, und ihre Lunge wird bei einer schweren Erkrankung geschädigt. Dabei verläuft COVID-19 bei einzelnen Hamsterarten unterschiedlich. Während sie bei Goldhamstern in der Regel nur einen moderaten Verlauf nimmt, erkranken Roborovski-Zwerghamster schwer.
Einzelzellanalyse: Codierte Zellproben während ihres Transports in winzigen Tröpfchen.
Woran das liegt und welche Prozesse sich in den Zellen der Lunge tatsächlich abspielen, haben unter anderem Einzelzellanalysen am BIMSB gezeigt. Die Forschenden lassen hierbei die einzelnen Zellen einer Probe über einen Chip laufen. Dort werden sie zusammen mit einem Barcode in kleine wässrige Tröpfchen verpackt. Auf diese Weise kann die RNA – der Teil des Erbgutes, den die Zelle gerade abgelesen hatte – sequenziert und später der Zelle wieder zugeordnet werden. Aus den gewonnenen Daten lässt sich mit hoher Präzision auf die Funktion der Zelle schließen. „So konnten wir beobachten, wie bestimmte Zellen des Immunsystems in der Lunge – die Monozyten und daraus entstehende Makrophagen – das Virus aufnehmen und sehr heftig reagieren. Sie senden Botenstoffe aus, die eine starke Entzündungsreaktion hervorrufen. In unserem Modell wird diese recht schnell wieder eingefangen, denn andere Immunzellen – die T-Zellen – schwärmen zu diesem Zweck aus. Bei schweren COVID-19-Verläufen geschieht das nicht“, erklärt Dr. Geraldine Nouailles, Wissenschaftlerin an der Medizinischen Klinik mit Schwerpunkt Infektiologie und Pneumologie der Charité und Co-Erstautorin der Studie. „Für eine erfolgreiche Genesung von COVID-19 ist eine schnelle und effiziente T-Zell-Antwort zentral.“
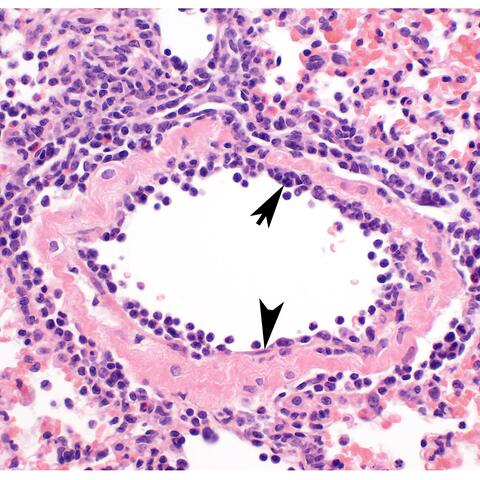
Das Endothel, die auskleidenden Zellen der Blutgefäße (Pfeilspitze), wird selbst nicht infiziert, reagiert jedoch sehr stark auf das Virus. Es löst damit eine Einwanderung von Entzündungszellen, vorrangig von T-Zellen (Pfeil), aus. Balken: 50µm
Während das Immunsystem im Zuge einer COVID-19-Erkankung in Aufruhr gerät, vermehrt sich SARS-CoV-2 in der Lunge und in den Zellen der Atemwege zunächst nur schwach. „Die Zerstörung des Lungengewebes bei schweren COVID-19-Verläufen wird nicht direkt durch die Vermehrung des Virus in den Zellen verursacht, sondern durch die starke Entzündungsreaktion“, erklärt MDC-Wissenschaftler Dr. Emanuel Wyler, ebenfalls Co-Erstautor. „Das scheint auf die Zellen der Blutgefäße, insbesondere die Endothelzellen in der Lunge, ebenfalls zuzutreffen. Sie reagieren stark auf das Virus, werden aber nicht von ihm infiziert und gehen nicht zugrunde.“ Nimmt die Krankheit einen schweren Verlauf, können verschlossene Blutgefäße und instabile Gefäßwände zu einem akuten Lungenversagen führen. Bei moderaten COVID-19-Erkrankungen dagegen spielen Gefäßschäden sehr wahrscheinlich keine Rolle. „Dass das Endothel, eine Art Schutzschild in den Gefäßen – das unter anderem verschiedene Prozesse in den Mikrogefäßen der Lunge regelt – bei einer COVID-19 aktiviert wird, hatten wir erwartet. Dass diese Zellen zugleich aktiver Motor der Entzündung sind, hat uns eher überrascht“, sagt Witzenrath. „Man könnte demnach auf zwei Arten therapeutisch an diesen für den Krankheitsverlauf zentralen Zellen angreifen. Zum einen mit Substanzen, die die Endothelbarriere abdichten. Zum anderen mit solchen, die das Endothel beruhigen. Eine davon erforschen wir bereits seit etwa zwei Jahren im Sonderforschungsbereich SFB-TR84 und konnten zeigen, dass sie bei Pneumonie und Beatmung erfolgreich ist.“ Aktuell ebenfalls getestete entzündungshemmende Medikamente gegen COVID-19 setzen an der Immunreaktion als solches an, sie wirken auch auf Monozyten und Makrophagen und bremsen diese ab.
Die Zerstörung des Lungengewebes bei schweren COVID-19-Verläufen wird nicht direkt durch die Vermehrung des Virus in den Zellen verursacht, sondern durch die starke Entzündungsreaktion.
Das nun bestätigte Modell soll zur Entwicklung von wirksamen und sicheren Therapien bei COVID-19 beitragen. Ziel ist es, die Zahl von Patient*innen mit schweren Lungenschäden zu reduzieren. Derzeit analysiert das multidisziplinäre Forschungsteam die Reaktionen der unterschiedlichen Zellarten im Roborovski-Zwerghamster. Die Forschenden wollen herausfinden, warum die Infektion hier schwerer verläuft und nicht selbstlimitierend ist wie im Fall des Goldhamsters. „Wir hoffen, dass wir damit auch einen Erklärungsansatz dafür finden, warum manche Menschen schwer an COVID-19 erkranken und andere nicht“, sagt Geraldine Nouailles. Allerdings muss hierfür noch das Genom des Zwerghamsters entschlüsselt werden. Da Hamster in der Versuchstierkunde bislang eher als Exoten galten, bestehen noch einige Wissenslücken. „Teilweise konnten wir diese nun mit Informationen aus der aktuellen Untersuchung schließen. Das ist, auch im Sinne einer bewussten und gezielten Nutzung von Tieren in der medizinischen Forschung, ein großer Fortschritt“, erläutert Co-Letztautor Dr. Jakob Trimpert, Virologe und Tiermediziner an der Freien Universität Berlin. Mit seinem Team hat er die COVID-19-Hamstermodelle entwickelt und zusammen mit den Tierpathologen der FU Berlin unter Leitung von Professor Achim Gruber die mikroskopischen Untersuchungen von infiziertem Lungengewebe durchgeführt. Diese histopathologischen Analysen haben wesentlich zu den nun vorliegenden Erkenntnissen der Studie beigetragen.
- Über die Studie
-
-
Gefördert wurden die Arbeiten unter anderem durch die Deutsche Forschungsgemeinschaft (DFG) im Sonderforschungsbereich SFB-TR84, das Bundesministerium für Bildung und Forschung (BMBF) mit dem Projekt CAPSyS-COVID und das Berlin Institute of Health (BIH) in der Charité mit CM-COVID. Ebenfalls ermöglicht hat die Studie das BMBF-geförderte Nationale Forschungsnetzwerk der Universitätsmedizin zu Covid-19 (NUM), im Teilvorhaben NAPKON, einem umfassenden Pandemie-Kohortennetzwerk.
Gemeinsame Pressemitteilung der Charité, des MDC und der Freien Universität Berlin
Weitere Informationen
Literatur
Nouailles, Geraldine et al. (2021): Longitudinal omics in Syrian hamsters integrated with human data unravel cellular effector responses to moderate COVID-19, in Nature Communications, DOI: 10.1038/s41467-021-25030-7
Bilder zum Download
Einblick in infiziertes Lungengewebe (Abb. A). Schon am zweiten Tag befällt SARS-CoV-2, rot markiert, fast alle Bereiche der Lunge. Nachteilig für die Lungenfunktion: Sowohl die auskleidenden Zellen der Atemwege (B, Pfeilspitze) als auch die für den Gasaustausch zuständigen Zellen der Lungenbläschen (Pneumozyten Typ I und II – Pfeil in C und D) werden durch das Virus befallen und zerstört. In den Fresszellen der Lunge, den Makrophagen, lassen sich Viruspartikel in großer Zahl nachweisen (E, Pfeilspitze). Balken: B = 50 µm, C - E = 20 µm © Dietert, Gruber, Freie Universität Berlin
Einzelzellanalyse: Codierte Zellproben während ihres Transports in winzigen Tröpfchen. © Felix Petermann, MDC
Das Endothel, die auskleidenden Zellen der Blutgefäße (Pfeilspitze), wird selbst nicht infiziert, reagiert jedoch sehr stark auf das Virus. Es löst damit eine Einwanderung von Entzündungszellen, vorrangig von T-Zellen (Pfeil), aus. Balken: 50µm © Dietert, Gruber, Freie Universität Berlin
Kontakte
Professor Martin Witzenrath
Medizinische Klinik mit Schwerpunkt Infektiologie und Pneumologie
Charité – Universitätsmedizin Berlin
Tel.: +49 30 450 553 892
martin.witzenrath@charite.de
Dr. Emanuel Wyler
AG RNA Biologie und Posttranscriptionale Regulation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
Tel.: +49 (0)30 9406-3009
emanuel.wyler@mdc-berlin.de
Jana Ehrhardt-Joswig
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
Tel.: +49-(0)30-9406-2118
jana.ehrhardt-joswig@mdc-berlin.de oder presse@mdc-berlin.de
- Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.