Ruhig Blut: Was Blutgefäße in Schach hält
In ihrem Inneren sind Blutgefäße von einer hauchdünnen Zellschicht ausgekleidet: Das Endothel ist eine entscheidende Barriere zwischen Blut und umliegenden Gewebe. Der einlagige Zellverband fördert den Austausch von Sauerstoff und Nährstoffen, verhindert aber gleichzeitig den unkontrollierten Austritt von Blutbestandteilen. Nur bei erhöhtem Stoffwechselbedarf des Gewebes, etwa bei Wachstum, Wundheilung oder auch wenn ein Tumor entsteht, geben Endothelzellen diesen stabilen Zellverband auf, um sich zu teilen und neue Blutgefäße zu bilden. Die Signale, die dieses Aktivwerden auslösen, sind gut untersucht. Wenig dagegen wusste man bisher, wie Endothelzellen ihren stabilen Ruhezustand aufrechterhalten. Genau dies haben nun Wissenschaftler*innen des Berlin Center for Translational Vascular Biomedicine zusammen mit einem internationalen Forschungsteam herausgefunden.
Denn Blutgefäße gibt es überall im Körper, und so spielen sie auch bei vielen Krankheiten eine tragende Rolle.
Professor Michael Potente ist Kardiologe und Blutgefäßforscher. Erst vor wenigen Monaten kam er vom Max-Planck-Institut für Herz- und Lungenforschung an das Berlin Institute of Health (BIH) in der Charité, wo er nun in seine neuen Labore im gerade eröffneten Käthe-Beutler-Haus in Berlin-Buch einzieht. Dort forscht er am Berlin Center for Translational Vascular Biomedicine. „Auch in diesen bewegten Zeiten haben wir mit Nachdruck an unserem großen Projekt gearbeitet, Blutgefäße besser zu verstehen“, erklärt der Professor für Vaskuläre Biomedizin. „Denn Blutgefäße gibt es überall im Körper, und so spielen sie auch bei vielen Krankheiten eine tragende Rolle.“
Ruhesignale gesucht
Normalerweise befinden sich Blutgefäße im erwachsenen Körper in einem stabilen Ruhezustand. Neue Gefäßkapillaren sprießen nur selten aus, etwa im weiblichen Zyklus, der Wundheilung oder aber bei krankhaften Prozessen wie dem Tumorwachstum. Die Signale, die die Endothelzellen dann anregen, sich zu teilen, sind zum Großteil bekannt. „Wir wollten jetzt verstehen, was Endothelzellen umgekehrt im Ruhezustand hält – ein Zustand, der auch als Quieszenz bezeichnet wird“, sagt Michael Potente.
Die Wissenschaftler*innen aus seinem Team wussten ziemlich genau, wo sie suchen mussten: „Es gibt Faktoren, die die Zelle daran hindern, sich zu vermehren. Ein solcher Faktor ist FOXO1, der das Ablesen von Erbinformation in Zellen steuert: Wenn wir FOXO1 in Endothelzellen ausschalten, wachsen die Gefäße übermäßig. Umgekehrt können wir durch das gezielte Anschalten dieses Faktors Blutgefäßbildung stoppen. Wir wollten nun herausfinden, wie genau FOXO1 das macht“, erklärt Jorge Andrade, einer der drei Erstautoren der Veröffentlichung.
Ein „Endothel-Beruhiger“?
Dazu überführten die Wissenschaftler*innen eine dauerhaft aktive Form von FOXO1 in Endothelzellen. Das führte dazu, dass Endothelzellen aufhörten, sich zu teilen und in einem Zustand der Inaktivität verharrten. Um herauszufinden wie FOXO1 das schafft, untersuchten die Forscher*innen den Stoffwechsel (Metabolismus) der Zellen. Hierzu isolierten sie sämtliche Stoffwechselprodukte aus den Zellen, die auch als Metabolite bezeichnet werden. „Dabei haben wir gesehen, das vor allem die Konzentration von 2-Hydoxyglutarat durch FOXO1 anstieg, einem Metaboliten, der in der Krebsmedizin bereits sehr bekannt ist“, berichtet Ana Costa, ebenfalls Erstautorin des Papiers. Die Forscher*innen fanden allerdings heraus, dass es sich um eine besondere Form des 2-Hydroxyglutarat handelt: das S-2-Hydroxyglutarat. „Diese Variante unterscheidet sich in Struktur und Funktion von dem in manchen Krebszellen gebildeten Metaboliten“, sagt Costa.
Unser langfristiges Ziel ist es, das Wachstum und die Funktion von Blutgefäßen gezielt und möglichst ohne Nebenwirkungen therapeutisch beeinflussen zu können.
Um die Rolle von S-2-Hydroxyglutarat als möglichem „Endothel-Beruhiger“ zu bestätigen, machten die Wissenschaftler*innen weitere Experimente mit den Endothelzellen: Sie gaben die Substanz in verschiedenen Konzentrationen und für verschiedene Zeiten zu normalen Endothelzellen. „Dabei haben wir beobachtet, dass allein S-2-Hydroxyglutarat in der Lage ist, Endothelzellen in der Quieszenz zu halten“, sagt Chenyue Shi, die dritte Erstautorin der Arbeit. Weitere Untersuchungen zeigten, dass das S-2-Hydroxyglutarat seine Wirkung entfaltet, indem es das Ablesen wachstumssteuernder Gene kontrolliert. Auch in Mausmodellen verhinderte das Stoffwechselprodukt das Auswachsen neuer Gefäße, hatte aber auf bereits vorhandene Blutgefäße keine negativen Auswirkungen. Entfernten die Wissenschaftler*innen 2-Hydroxyglutarat wieder, erlangten Endothelzellen ihre Fähigkeit, neue Blutgefäße zu bilden, wieder zurück.
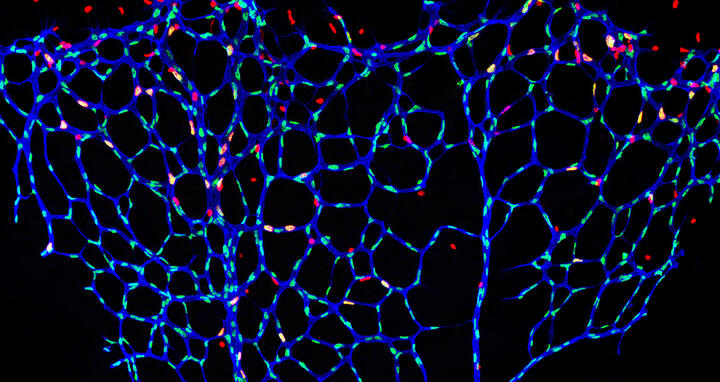
Gebremstes Blutgefäßwachstum: die mikroskopische Aufnahme zeigt die Netzhautgefäße einer Maus, bei der die S-2-Hydroxyglutarat-Spiegel im Endothel selektiv erhöht sind. Die Blutgefäße (blau) wurden durch Fluoreszenzfärbungen sichtbar gemacht. Die Zellkerne von sich teilenden Endothelzellen erscheinen gelb, die ruhenden Endothelzellen grün. Sich teilende Zellen, die nicht vaskulären Ursprungs sind, erscheinen rot.
Blutgefäße gezielt beeinflussen
„Gerade vor dem Hintergrund, dass ein „Zuviel“ oder ein „Zuwenig“ von neuen Blutgefäßen bei vielen Krankheiten eine Rolle spielt, ist es für uns enorm wichtig, die grundlegenden Mechanismen dahinter besser zu verstehen“, fasst Michael Potente die Ergebnisse zusammen. „Unser langfristiges Ziel ist es, das Wachstum und die Funktion von Blutgefäßen gezielt und möglichst ohne Nebenwirkungen therapeutisch beeinflussen zu können. Diesem Ziel sind wir mit der vorliegenden Arbeit ein Stück nähergekommen.“
Gemeinsame Pressemitteilung von BIH und MDC
Text: Stefanie Seltmann, BIH
Weiterführende Informationen
Literatur
Jorge Andrade, Chenyue Shi, Ana S. H. Costa et al. (2021): „Control of endothelial quiescence by FOXO-regulated metabolites“. Nature Cell Biology, DOI 10.1038/s41556-021-00637-6.
Foto zum Download
Gebremstes Blutgefäßwachstum: die mikroskopische Aufnahme zeigt die Netzhautgefäße einer Maus, bei der die S-2-Hydroxyglutarat-Spiegel im Endothel selektiv erhöht sind. Die Blutgefäße (blau) wurden durch Fluoreszenzfärbungen sichtbar gemacht. Die Zellkerne von sich teilenden Endothelzellen erscheinen gelb, die ruhenden Endothelzellen grün. Sich teilende Zellen, die nicht vaskulären Ursprungs sind, erscheinen rot. Foto: AG Potente.
Kontakte
Dr. Stefanie Seltmann
Leiterin Kommunikation & Marketing
Berlin Institute of Health (BIH)
Translationsforschungsbereich der Charité – Universitätsmedizin Berlin
+49 (0) 30 450 543019
s.seltmann@bihealth.de
Jutta Kramm
Leiterin Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 (0) 30 9406 2140
jutta.kramm@mdc-berlin.de
- Berlin Institute of Health (BIH)
-
-
Die Mission des Berlin Institute of Health (BIH) ist die medizinische Translation: Erkenntnisse aus der biomedizinischen Forschung werden in neue Ansätze zur personalisierten Vorhersage, Prävention, Diagnostik und Therapie übertragen, umgekehrt führen Beobachtungen im klinischen Alltag zu neuen Forschungsideen. Ziel ist es, einen relevanten medizinischen Nutzen für Patient*innen und Bürger*innen zu erreichen. Dazu etabliert das BIH als Translationsforschungsbereich in der Charité ein umfassendes translationales Ökosystem, setzt auf ein organübergreifendes Verständnis von Gesundheit und Krankheit und fördert einen translationalen Kulturwandel in der biomedizinischen Forschung. Das BIH wurde 2013 gegründet und wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung (BMBF) und zu zehn Prozent vom Land Berlin gefördert. Die Gründungsinstitutionen Charité – Universitätsmedizin Berlin und Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) waren bis 2020 eigenständige Gliedkörperschaften im BIH. Seit 2021 ist das BIH als so genannte dritte Säule in die Charité integriert, das MDC ist Privilegierter Partner des BIH.
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) wurde 1992 in Berlin gegründet. Es ist nach dem deutsch-amerikanischen Physiker Max Delbrück benannt, dem 1969 der Nobelpreis für Physiologie und Medizin verliehen wurde. Aufgabe des MDC ist die Erforschung molekularer Mechanismen, um die Ursachen von Krankheiten zu verstehen und sie besser zu diagnostizieren, verhüten und wirksam bekämpfen zu können. Dabei kooperiert das MDC mit der Charité – Universitätsmedizin Berlin und dem Berlin Institute of Health (BIH) sowie mit nationalen Partnern, z.B. dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DHZK), und zahlreichen internationalen Forschungseinrichtungen. Am MDC arbeiten mehr als 1.600 Beschäftigte und Gäste aus nahezu 60 Ländern; davon sind fast 1.300 in der Wissenschaft tätig. Es wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Berlin finanziert und ist Mitglied in der Helmholtz-Gemeinschaft deutscher Forschungszentren.