Wie die Immuntherapie effizienter werden kann
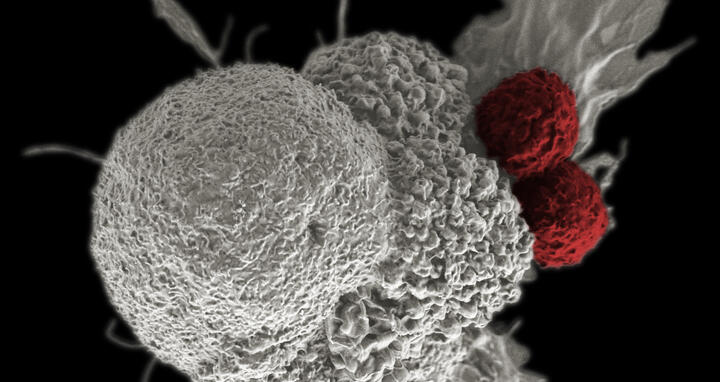
Sie sind das Räumkommando des Immunsystems: T-Zellen patrouillieren ständig durch Blut, Lymphsystem, Gewebe und Organe. Stoßen sie auf Zellen, die von Krankheitserregern befallen oder beschädigt sind, beseitigen sie diese. Auch Krebszellen können sie erkennen und vernichten. Allerdings entwickeln Tumorzellen Strategien, um sich dieser Abwehr zu entziehen. Weltweit arbeiten Krebsforscher*innen deshalb daran, diese Ausweichmanöver unmöglich zu machen und T-Zellen für gezielte Immuntherapien gegen Krebs zu nutzen.
Die Arbeitsgruppen von Dr. Armin Rehm und Dr. Uta Höpken am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) in Berlin haben nun einen Mechanismus identifiziert, mit dem Tumorzellen die körpereigene Immunabwehr umgehen. „In vielen Tumoren lesen die Zellen besonders oft das Gen EBAG9 ab. Die Krebszellen bilden deshalb ein Protein, das sie einerseits selbst schützt. Auf der anderen Seite hat EBAG9 auch Einfluss auf Zellen des Immunsystems, denn T-Zellen stellen EBAG9 ebenfalls her. In den T-Zellen verhindert EBAG9 die Abgabe von Enzymen, die als Zellgift wirken und Tumorzellen abtöten“, sagt Armin Rehm. Im Fachjournal „JCI Insight“ beschreiben die Wissenschaftler*innen, wie sie in Mäusen diese Bremse gelöst haben. „Wir haben das EBAG9-Gen stillgelegt“, erklärt Co-Erstautorin Dr. Anthea Wirges aus Rehms Forschungsgruppe. „So konnten wir verhindern, dass EBAG9 in den T-Zellen entsteht, und damit die Immunantwort gegen Krebs dauerhaft stärken.“
EBAG9 entwaffnet die Immunzellen
Wir haben diese genveränderten Mäuse über einen langen Zeitraum beobachtet. Bei ihnen entwickeln sich die Tumore deutlich langsamer als in den Mäusen mit EBAG9.
Dass Krebszellen Immunzellen ausbremsen können, ist bekannt. Darauf beruhen Immuntherapien mit Checkpoint-Inhibitoren, die bereits in der Klinik verwendet werden. Die Checkpoint-Inhibitoren machen es den Krebszellen schwer, sich als „ungefährlich“ zu maskieren und so den T-Zellen zu entkommen. „Mit EBAG9 haben die Krebszellen aber einen zusätzlichen Schutz vor dem Immunsystem“, sagt Rehm. „EBAG9 entwaffnet die T-Zellen und drosselt die Ausschüttung von Stoffen, die ihnen schaden würden.“
Armin Rehm und Uta Höpken hegen schon lange den Verdacht, dass EBAG9 die T-Zellen ausbremst. Bereits 2009 etablierte Rehms Team ein Mausmodell, bei dem die Wissenschaftler*innen das Gen für EBAG9 ausschalteten. „Ohne EBAG9 funktionierte das Immunsystem der Tiere besser und sie konnten sich gegen Infektionen wesentlich effizienter zur Wehr setzen“, sagt Armin Rehm. Das Team von Uta Höpken kreuzte die Mäuse ohne EBAG9 dann mit einem weiteren genetisch veränderten Mausmodell, das spontan Leukämie entwickelt. „Wir haben diese doppelt genveränderten Mäuse über einen langen Zeitraum beobachtet“, erzählt Uta Höpken. „Bei ihnen entwickeln sich die Tumore deutlich langsamer als in den Mäusen mit EBAG9.“
Anders als bei Infektionen
Anthea Wirges überprüfte die Effekte des EBAG9-Gens auf die T-Zellen mithilfe von Einzelzell-RNA-Sequenzierung und bioinformatischen Methoden. Anhand der Daten konnten die Wissenschaftler*innen nicht nur bestätigen, dass EBAG9 die T-Zellantwort hemmt. Sie fanden auch heraus, dass die Immunreaktion bei Krebserkrankungen anders abläuft als bei Infektionen.
Armin Rehm (links) und Uta Höpken (rechts)
„Das Wissen darüber, wie das Immunsystem ein Gedächtnis aufbaut, stammt aus Infektionsversuchen. Dies kann nicht 1:1 auf Tumore übertragen werden“, sagt Armin Rehm. T-Zellen erkennen kranke oder infizierte Zellen an Signalmolekülen auf deren Oberfläche. Identifizieren sie solche schädlichen Strukturen, differenzieren sie in zytotoxische T-Zellen und T-Gedächtniszellen. Die zytotoxischen T-Zellen schütten Proteine aus, die die Membranen der erkrankten Zellen durchlöchern, in sie eindringen und vergiften, so dass sie absterben. Außerdem produzieren infizierte Gewebe entzündliche Botenstoffe, etwa Zytokine, die noch mehr T-Zellen herbeirufen und die Ausreifung der T-Zellen zu T-Gedächtniszellen steuern. Die Gedächtniszellen speichern die Immunantwort ab, sodass das Immunsystem nicht jedes Mal von vorn anfangen muss, wenn T-Zellen auf erkrankte Zellen stoßen.
Die Idee: CAR-T-Zellen ohne Immunbremse
Je heftiger die T-Zellen am Anfang reagieren, umso besser fällt das T-Zellgedächtnis im Anschluss aus.
Tumore im frühen Stadium gehen jedoch nicht mit einer Entzündung einher. Bislang ist man davon ausgegangen, dass dies daran liegt, dass T-Zellen Tumorzellen nicht gut identifizieren können. „Als körpereigene Zellen weisen Tumorzellen nur ganz wenige Oberflächenmoleküle auf, die als fremde Strukturen erkennbar sind“, erläutert Uta Höpken. Doch offenbar reichen den T-Zellen diese minimalen Unterschiede aus, um Tumorzellen aufspüren zu können. Denn nachdem die Forscher*innen EBAG9 ausgeschaltet hatten, kam es zu einer überwältigenden Abbaureaktion. „Die enthemmten T-Zellen beseitigen Tumorzellen sehr früh und sehr radikal“, sagt Armin Rehm. Auch dauerhaft baut sich so ein Schutz vor Tumorzellen auf. „Je heftiger die T-Zellen am Anfang reagieren, umso besser fällt das T-Zellgedächtnis im Anschluss aus“, sagt Rehm.
„Basierend auf diesen Ergebnissen wollen wir nun CAR-T-Zellen ohne die Immunbremse EBAG9 für eine Immuntherapie gegen Blutkrebs entwickeln“, sagt Anthea Wirges. CAR steht für chimärer Antigen-Rezeptor – ein künstlich geschaffener Rezeptor, der Tumorzellen aufspürt und der in patienteneigene T-Zellen integriert wird. Bekommen die Patient*innen eine Infusion mit den CAR-T-Zellen, können diese den Krebs bekämpfen. Die MDC-Wissenschaftler*innen gehen davon aus, dass sie ohne EBAG9 noch viel wirkungsvoller sind. Bis zu einer klinischen Studie wird zwar noch einige Zeit verstreichen. „Wir hoffen aber nicht nur, damit die Therapie von Leukämien und Lymphomen effizienter zu machen. Wir hoffen sogar, diese Krankheiten heilen zu können“, sagt Armin Rehm.
Text: Jana Ehrhardt-Joswig
Weitere Informationen
Literatur
Armin Rehm et al (2022): „EBAG9 controls CD8 + T cell memory formation responding to tumor challenge in mice“. JCI Insight, DOI: 10.1172/jci.insight.155534
Kontakte
Dr. Armin Rehm
AG Translationale Tumorimmunologie
Max-Delbrück-Centrum für Molekulare
Medizin in der Helmholtz-Gemeinschaft (MDC)
Tel.: +49 30 9406-3817
arehm@mdc-berlin.de
Jana Schlütter
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 30 9406-2121
jana.schluetter@mdc-berlin.de oder presse@mdc-berlin.de
- Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.