Autoantikörper bei COVID-19: nicht immer schädlich?
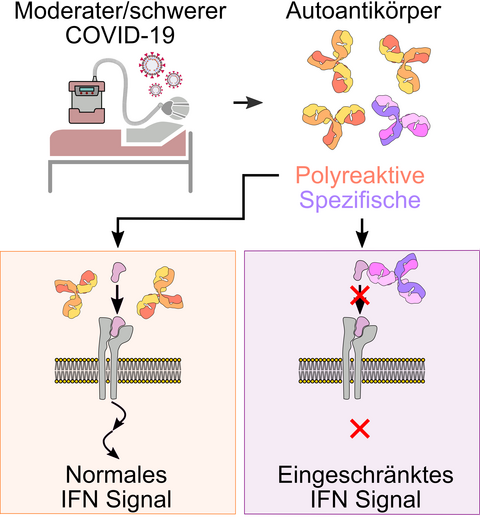
Im Sommer 2020 sorgte eine Entdeckung einer französischen Arbeitsgruppe um den Immunologen Jean-Laurent Casanova für Aufsehen: Sein Team hatte im Blut von schwerkranken COVID-19-Patient*innen Antikörper gefunden, die sich ausgerechnet gegen den Botenstoff Typ-1-Interferon richten. Der Körper bildet Interferon, um sich vor den Viren zu schützen, wenn die Autoantikörper an Interferon binden, machen sie es damit wirkungslos – und den Patienten oder die Patientin schutzlos.
„In der Folge haben sich viele Immunologen auf die Suche nach weiteren Autoantikörpern im Blut von COVID-19-Patienten gemacht“, erzählt Dr. Kathrin de la Rosa, die eine Johanna Quandt-Professur für Immunmechanismen in der Translation am Berlin Institute of Health in der Charité (BIH) innehat und auch am Max Delbrück Center forscht. „Und sie wurden fündig: Man hat bisher insgesamt 17 Antikörper gegen körpereigene Strukturen entdeckt, unter anderem gegen das ACE2-Protein, das als Rezeptor für das Virus dient.“
Die Autoantikörper erkennen ein breites Spektrum von Zielen
Mikhail Lebedin und Kathrin de la Rosa im Labor am MDC.
Auch Kathrin de la Rosa untersuchte mit ihrem Team das Blut von COVID-19-Patient*innen, die in der Charité behandelt wurden. Auch sie fanden Autoantikörper gegen das ACE2-Protein, gegen Interferon alpha und weitere Körpereiweiße. „Interessanterweise war der Zusammenhang zwischen löslichem ACE2 und ACE2-bindenden Autoantikörpern nicht eindeutig. Auch das zeitliche Auftreten der Autoantikörper sprach gegen eine ACE2-gerichtete Immunreaktion“, berichtet Mikhail Lebedin, Doktorand bei Kathrin de la Rosa und Erstautor der aktuellen Arbeit. „Dafür fanden wir einen Zusammenhang zwischen den Mengen verschiedener Autoantikörper. Das machte uns stutzig.“
Wieso könnte die Infektion mit COVID-19 gleiche Mengen verschiedener Antikörper hervorrufen, fragten sich die Antikörper-Spezialisten. Handelt es sich womöglich um ein- und dieselben Antikörper, die an verschiedene Körpereiweiße binden können? Sozusagen multi-spezifische Antikörper?
Die Wissenschaftler*innen testeten daraufhin die Reaktivität der Antikörper aus dem Blut der COVID-Patient*innen. Die große Mehrheit der Proben zeigte eine ungerichtete Autoimmunität, da die Antikörper ähnlich stark verschiedenste Eiweiße erkannten. In nur wenigen Proben waren die Autoantikörper auf ein bestimmtes Ziel gerichtet. Kathrin de la Rosa kommentiert: „Für COVID-19 stellte sich nun die Frage, ob multi-spezifische Antikörper einen Einfluss auf den Krankheitsverlauf haben können, oder ob dies ausschließlich für gerichtete Autoantikörper der Fall ist. Ungerichtete Antikörper sind auch bei anderen Infektionskrankheiten wie dem Pfeifferschen Drüsenfieber oder HIV bekannt.“
Ungerichtete Autoantikörper ohne Auswirkung auf Interferon-Signalweg
Die Wissenschaftler*innen testeten daraufhin diese Antikörper auf ihre Funktionalität: In der Kulturschale brachten sie gesunde Blutzellen mit den Autoantikörpern der Patient*innen zusammen und beobachteten, ob das einen Einfluss auf das Wachstum oder Verhalten der Zellen hatte. „Die Zellen reagierten überhaupt nicht auf das Vorhandensein der multi-reaktiven Antikörper. Nur wenn wir zielgerichtete mono-spezifische Antikörper zu den Zellen gaben, änderte sich ihr Verhalten“, berichtet Mikhail Lebedin.
Kathrin de la Rosa möchte nicht die Bedeutung von Autoantikörpern generell in Frage stellen. „Gerade die Autoantikörper gegen das Interferon vom Typ-1 tragen mit Sicherheit zum schweren Krankheitsverlauf bei. In Bezug auf die Diagnostik und auf therapeutische Maßnahmen sollte man jedoch noch einmal überprüfen, ob tatsächlich Antikörper vorliegen, die ganz spezifisch ein bestimmtes Körpereiweiß erkennen. Womöglich handelt es sich nur um einen mehr oder weniger harmlosen Vertreter der multi-spezifischen Autoantikörper.“
Text: BIH
Weiterführende Informationen
Literatur
Mikhail Lebedin et al (2023): „Discriminating promiscuous from target-specific autoantibodies in COVID-19“. European Journal of Immunology, DOI: 10.1002/eji.202250210
Bild zum Download
Kathrin de la Rosa im Labor.
Foto: Pablo Castagnola, Max Delbrück Center
Kontakte
Prof. Dr. Kathrin de la Rosa
Leiterin der Arbeitsgruppe „Krebs & Immunologie / Immunmechanismen und humane Antikörper“
Max Delbrück Center
Kathrin.delaRosa@mdc-berlin.de
Dr. Stefanie Seltmann
Leiterin Stabsstelle Kommunikation
Berlin Institute of Health at Charité (BIH)
+49 (0) 30 450 543019
stefanie.seltmann@bih-charite.de
Jana Schlütter
Redakteurin, Kommunikation
Max Delbrück Center
+49 (0)30 9406 2121
jana.schluetter@mdc-berlin.de oder presse@mdc-berlin.de
- BIH Johanna Quandt-Professuren
-
-
Die Stiftung Charité und das BIH haben gemeinsam die BIH Johanna Quandt-Professuren (W2‐Professuren auf Zeit mit einem echten Tenure Track) ins Leben gerufen. Das neuartige und international ausgeschriebene Professurenformat richtet sich gezielt an Wissenschaftlerinnen, um einen Impuls zur Förderung von Chancengleichheit in den Lebenswissenschaften zu setzen. In diesem Zusammenhang sind die Professuren mit einer verbindlichen Option zur Verstetigung als Lebenszeitprofessur versehen (echter Tenure Track). Außerdem zeichnen sich die Professuren durch eine besondere thematische Offenheit (Open Topic) aus; die Bewerberinnen waren aufgefordert worden, die Ausrichtung ihrer Professuren auch fernab der üblichen biomedizinischen Disziplinen selbst zu gestalten und so innovativ zum translationalen Auftrag des BIH beizutragen. Gemeinsam mit den drei bereits 2017 ausgewählten Johanna Quandt-Professorinnen bereichern insgesamt sechs BIH Johanna Quandt-Professuren die Lebenswissenschaften in Berlin.
- Max Delbrück Center
-
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (Max Delbrück Center) gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 70 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organ-übergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das Max Delbrück Center fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am Max Delbrück Center arbeiten 1800 Menschen. Finanziert wird das 1992 gegründete Max Delbrück Center zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.