Erste Inselzell-Organoide mit Blutgefäßen
Erstmals ist es gelungen, aus menschlichen pluripotenten Stammzellen ein vaskularisiertes Organoid-Modell der Langerhansinseln in der Bauchspeicheldrüse zu entwickeln. Das berichtet ein internationales Forschungsteam unter der Leitung von Professorin Maike Sander, Wissenschaftliche Vorständin des Max Delbrück Center, in der Fachzeitschrift „Developmental Cell“. Die Langerhansinseln in der Bauchspeicheldrüse beherbergen unterschiedliche Arten hormonproduzierender Zellen, darunter die für die Insulin-Ausschüttung zuständigen Betazellen. Forschende der Arbeitsgruppe Sander an der University of California in San Diego haben nun herausgefunden, dass Insel-Organoide mit integrierten Blutgefäßen eine größere Anzahl reifer Betazellen enthielten und mehr Insulin produzierten als ihre nicht vaskularisierten Gegenstücke. Die vaskularisierten Organoide ahmten die im Körper vorhandenen Inselzellen besser nach.
„Unsere Ergebnisse unterstreichen, wie wichtig das Netzwerk der Gefäße für die Funktion der Inselzellen in der Bauchspeicheldrüse ist“, sagt Sander. „Dieses Modell ermöglicht es uns, die natürliche Umgebung der Bauchspeicheldrüse besser nachzuahmen. Das ist für die Diabetesforschung und die Entwicklung neuer Behandlungsmethoden entscheidend.“
Eine Ingenieursleistung: Stammzellinseln mit Blutgefäßen
Aus Stammzellen entwickelte Inselzell-Organoide – also Mini-Organe, die Insulin produzierende Zellverbände außerhalb des Körpers nachbilden – nutzen Forschende, um Diabetes und andere endokrine Erkrankungen der Bauchspeicheldrüse besser zu verstehen. Die Beta-Zellen in diesen Organoiden bleiben jedoch in der Regel unreif. Das macht sie zu suboptimalen Modellen der In-vivo-Bedingungen, sagt Sander. Obwohl es verschiedene Ansätze gibt, die die Reifung der Betazellen fördern sollen, blieb deren Erfolg begrenzt, sagt Sander.
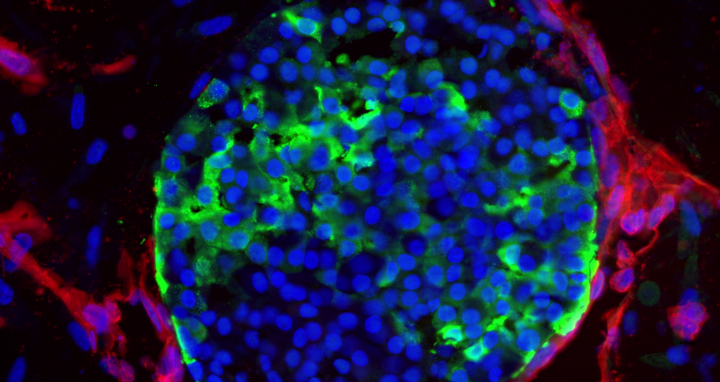
Das Forschungsteam hat geeignete Kulturbedingungen ermittelt, um vaskularisierte Stammzellinseln zu züchten. Das Bild zeigt die Blutgefäße (blau), die sich eng an die Inselzellen (grün) schmiegen.
Um die natürliche Umgebung besser nachzuahmen, fügten die Wissenschaftler*innen zwei Zelltypen zu den aus Stammzellen gezüchteten Insel-Organoiden hinzu: menschliche Endothelzellen, die die Blutgefäße auskleiden, und Fibroblasten, Zellen, die an der Bildung von Bindegewebe beteiligt sind. Das Teamexperimentierte mit verschiedenen Zellkulturmedien, bis sie die richtige Mischung gefunden hatte. Die Zellen überlebten nicht nur, sondern reiften und bildeten ein Netzwerk von röhrenförmigen Blutgefäßen, die die Inseln umgaben und durchzogen.
„Die Entwicklung der richtigen Rezeptur war unser Durchbruch“, sagt Sander. „Fünf Jahre lang hat ein engagiertes Team von Stammzellbiolog*innen und Bioingenieur*innen nach den geeigneten Bedingungen gesucht.“
Vaskularisierte Inselzell-Organoide sind reifer
Beim Vergleich von vaskularisierten und nicht vaskularisierten Organoiden zeigte sich, dass Inseln mit Blutgefäßen mehr Insulin ausschütten, wenn sie hohen Glukosewerten ausgesetzt waren. „Unreife Betazellen reagieren hingegen nicht gut auf Glukose. Das zeigte uns, dass das vaskularisierte Modell reifere Zellen bildete“, sagt Sander.
Anschließend untersuchten die Wissenschaftler*innen, wie das Gefäßsystem den Organoiden genau bei der Reifung hilft. Sie identifizierten zwei Schlüsselmechanismen: Endothelzellen und Fibroblasten unterstützen einerseits den Aufbau einer extrazellulären Matrix – das ist ein Netzwerk aus Proteinen und Kohlenhydraten auf der Zelloberfläche. Die Bildung der Matrix selbst signalisiert den Zellen, dass sie reifen sollen. Andererseits schütten die Endothelzellen das knochenmorphogenetische Protein (BMP) aus, das wiederum die Betazellen zur Reifung anregt.
Da auch mechanische Kräfte die Insulinausschüttung stimulieren, integrierte das Team die Organoide in Mikrofluidik-Chips, sodass sie die Nährlösung direkt durch die Gefäßnetzwerke pumpen konnten. Dabei nahm der Anteil reifer Betazellen sogar weiter zu.
„Wir haben ein Gefälle festgestellt“, sagt Sander. „Nicht-vaskularisierte Organoide wiesen besonders viele unreife Zellen auf, mit der Vaskularisierung reiften deutlich mehr und noch besser wurde es, als wir die Nährstoffversorgung durch die Blutgefäße herstellen konnten. Ein menschliches Zellmodell der Langerhansinseln, das die Physiologie der Bauchspeicheldrüse in vivo recht genau nachbildet, eröffnet uns neue Möglichkeiten, die grundlegenden Mechanismen von Diabetes zu untersuchen“, fügt sie hinzu.
In einem letzten Schritt wiesen die Forschenden nach, dass vaskularisierte Inselzell-Organoide auch im lebenden Organismus mehr Insulin ausschütten. Diabetische Mäuse, die keine vaskularisierten Inselzell-Transplantate erhielten, schnitten schlechter ab als Mäuse, denen vaskularisierte Inselzellen eingepflanzt wurden. Einige dieser Mäuse zeigten 19 Wochen nach der Transplantation keinerlei Anzeichen einer Erkrankung mehr. Diese Ergebnisse bestätigen andere Studien, die gezeigt hatten, dass eine vorgeschaltete Vaskularisierung die Funktion transplantierter Inseln verbessert.
Ein neues Modell für die Forschung an Typ-1-Diabetes
Sander will nun mit den vaskularisierten Inselzell-Organoid-Modelle Typ-1-Diabetes untersuchen. Typ-1-Diabetes wird durch Immunzellen verursacht, die die Betazellen in der Bauchspeicheldrüse angreifen und zerstören – im Gegensatz zum Typ-2-Diabetes, bei dem die Bauchspeicheldrüse mit der Zeit weniger Insulin produziert und die Körperzellen gegen die Wirkung des Insulins resistent werden.
Sie und ihr Team am Max Delbrück Center züchten vaskularisierte Organoide aus Zellen von Typ-1-Diabetiker*innen. Diese Organoide übertragen sie auf Mikrofluidik-Chips und geben Immunzellen der Erkrankten hinzu. „Wir wollen verstehen, wie die Immunzellen die Betazellen zerstören“, erklärt Sander. „Unser Ansatz liefert ein realistischeres Modell für die Funktion der Inselzellen und könnte dazu beitragen, in Zukunft bessere Behandlungsmethoden zu entwickeln.“
Text: Gunjan Sinha
Weiterführende Informationen
Die Vordenkerin: Porträt über Maike Sander
Literatur
Yesl Jun, Kim Vy, et al. (2025): “Engineered vasculature induces functional maturation of pluripotent stem cell-derived islet organoids.” Developmental Cell. DOI: 10.1016/j.devcel.2025.04.024
Foto zum Download
Das Forschungsteam hat geeignete Kulturbedingungen ermittelt, um vaskularisierte Stammzellinseln zu züchten. Das Bild zeigt die Blutgefäße (blau), die sich eng an die Inselzellen (grün) schmiegen.
Foto: AG Sander
Kontakte
Prof. Maike Sander
Leiterin der Arbeitsgruppe „Pancreatic Organoid Research and Disease Modeling“
Max Delbrück Center
Maike.Sander@mdc-berlin.de
Gunjan Sinha
Redakteurin, Kommunikation
Max Delbrück Center
+49 30 9406-2118
Gunjan.Sinha@mdc-berlin.de oder presse@mdc-berlin.de
- Max Delbrück Center
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft legt mit seinen Entdeckungen von heute den Grundstein für die Medizin von morgen. An den Standorten in Berlin-Buch, Berlin-Mitte, Heidelberg und Mannheim arbeiten unsere Forschenden interdisziplinär zusammen, um die Komplexität unterschiedlicher Krankheiten auf Systemebene zu entschlüsseln – von Molekülen und Zellen über Organe bis hin zum gesamten Organismus. In wissenschaftlichen, klinischen und industriellen Partnerschaften sowie in globalen Netzwerken arbeiten wir gemeinsam daran, biologische Erkenntnisse in praxisnahe Anwendungen zu überführen – mit dem Ziel Frühindikatoren für Krankheiten zu identifizieren, personalisierte Behandlungen zu entwickeln und letztlich Krankheiten vorzubeugen. Das Max Delbrück Center wurde 1992 gegründet und vereint heute eine vielfältige Belegschaft mit 1.800 Menschen aus mehr als 70 Ländern. Wir werden zu 90 Prozent durch den Bund und zu 10 Prozent durch das Land Berlin finanziert.