AG E. Wanker
Proteomforschung und molekulare Mechanismen bei neurodegenerativen Erkrankungen
Profil
Die Essigfliege - Drosophila melanogaster, so ihr zoologischer Name - ist ein Modellorganismus, der uns hilft zu verstehen, wie die Krankheit die Nervenzellen im Gehirn beeinträchtigt.
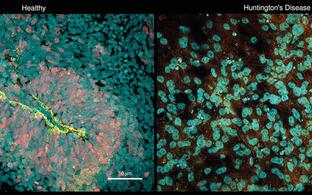
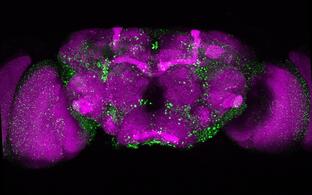
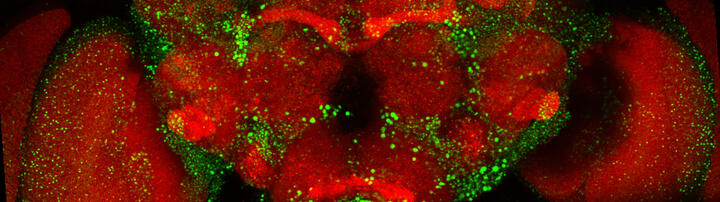
Konfokales Mikroskopie-Bild eines Drosophila-Gehirns, in dem die Expression von Huntingtin mit einer verlängerten Polyglutamin-Sequenz für 6 Tage eingeschaltet und für die folgenden 18 Tage ausgeschaltet wurde. Rot: Synapsen, die in allen neuronalen Zellen vorhanden sind. Grün: Huntingtin-Aggregate, die sich bilden und im Gehirn ablagern.
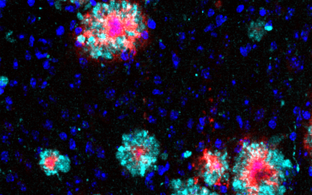
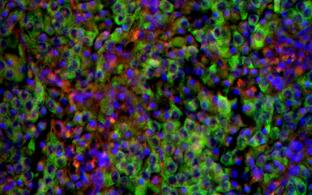
Wir haben Huntington-Fliegenmodelle etabliert, die es ermöglichen, Huntingtin-Proteine, deren Aggregation und Verbreitung spezifisch in Neuronen, in vivo zu untersuchen. Siehe: Anne Ast et al. "mHTT Seeding Activity: A Marker of Disease Progression and Neurotoxicity in Models of Huntington's Disease". Molecular Cell. 2018 Sep 6;71(5):675-688.e6. https://doi.org/10.1016/j.molcel.2018.07.032.
Mehr über unsere Forschung:
Millionen Menschen weltweit leiden an neurodegenerativen Erkrankungen wie Alzheimer, Parkinson oder der Huntington-Krankheit. Die meisten dieser Leiden brechen im fortgeschrittenen Alter aus. Bedingt durch den demografischen Wandel in vielen Gesellschaften hin zu höheren Anteilen älterer Menschen steigt die Zahl der Erkrankten stetig an.
Trotzdem verstehen wir die genauen Grundlagen der Entstehung dieser Erkrankungen noch nicht. Ein gemeinsames Charakteristikum vieler neurodegenerativer Leiden ist die Ablagerung fehlgefalteter Proteine im Gehirn von Patienten.
Meine Forschungsgruppe beschäftigt sich mit ‚Neuroproteomik‘, der Protein-basierten Untersuchung neurodegenerativer Erkrankungen. Wir beleuchten die molekularen Prinzipien, durch die Proteine, oft aufgrund abnormaler Faltung, einzeln oder in Wechselwirkung, toxisch für Nervenzellen werden, ihre Funktion beeinträchtigen, und letztlich zu Neurodegeneration, ihrem Absterben, führen.
Wir verfolgen zwei Hauptforschungsrichtungen: Hypothesen-getriebene molekulare Studien zur Aggregation und Verbreitung von fehlgefalteten Proteinen einerseits, systematische Protein-Protein-Interaktionsstudien oder ‚Interaktomik‘ andererseits. Klicken Sie oben auf „Forschung“ um mehr über unsere aktuellen Projekte und Schwerpunkte zu erfahren.
Team
Prof. Dr. Erich Wanker, Dipl.-Ing.
Forschungsgruppenleiter
Orchid Wael Mostapha Ammar, MSc
Doktorandin
Stephanie Beetz, MSc
Technische Mitarbeiterin
Dr. Annett Böddrich, Dipl. Biol.
Wissenschaftlerin, Projektleiterin
Dr. Annika Deckert, MSc
Wissenschaftlerin (Postdoc)
Christian Hänig, Dipl.-Ing.
Informatiker, IT, Automatisierung
Nancy Neuendorf, BTA
Technische Mitarbeiterin (senior)
Roxane Maria Papawassiliou, MSc
Doktorandin
Leonard Roth, MSc
Doktorand
Sigrid Schnögl, Mag. phil., MBA
Koordinatorin
Dr. Eduardo Silva Ramos, MSc
Wissenschaftler (Postdoc)
Theo Wallenfang, MSc
Doktorand
Martina Zenkner, Dipl.-Ing.
Technische Mitarbeiterin (senior), Laborleiterin
Forschung
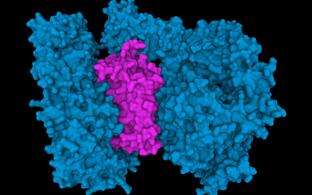
Insbesondere wollen wir die molekularen Prinzipien aufklären, durch die abnormal gefaltete Proteine, ihre Komplexe und Aggregate zelluläre Toxizität und neuronale Dysfunktion verursachen. Um die Umsetzung von Grundlagenforschung in Nutzen für Patienten zu fördern, identifizieren und charakterisieren wir Modulatoren von Proteinfehlfaltungskaskaden in Krankheiten (Ehrnhoefer et al., Nat Struct Mol Biol, 2008; Bieschke et al., Nat Chem Biol, 2011). Wir haben gezeigt, dass erweiterte Polyglutamin (polyQ)-Sequenzen die Fehlfaltung und Aggregation von N-terminalen Huntingtin-Fragmenten in vitro und in vivo auslösen (Scherzinger et al., Cell, 1997; Davis et al., Cell, 1997). In jüngerer Vergangenheit haben wir neue, translationale Forschungsthemen begonnen und Methoden zum Nachweis krankheitsrelevanter fehlgefalteter Proteinspezies in biologischen Proben von Modellen und Patienten etabliert. Diese Untersuchungen zielen auf die Entwicklung prädiktiver Krankheitsmarker ab, die eine Voraussetzung für die klinische Entwicklung neuer Therapien sind, die kausal auf die molekularen Mechanismen der Neurodegeneration zielen und verhindern können, dass eine irreversible neuronale Schädigung auftritt.
In unseren Interaktomik-Aktivitäten haben wir ein automatisiertes Hefe-Zwei-Hybrid (Y2H)-System etabliert, mit dem wir ein fokussiertes Protein-Protein-Interaktionsnetzwerk für das Huntingtin-Protein, das für die Huntington-Krankheit relevant ist, generiert haben (Goehler et al., Mol. Cell, 2004), sowie eine umfassende Interaktionskarte des menschlichen Proteoms (Stelzl et al., Cell, 2005). Des weiteren haben wir hochrelevante Interaktionen zwischen der Triple-A-ATPase VCP/p97 und einem Adaptorprotein identifiziert, die eine fundamentale strukturelle Veränderung in VCP von einem Homohexamer zu einem Heterooligomer mit weitreichenden funktionellen Implikationen bewirken (Arumughan et al. 2016). Wir entwickeln ständig leistungsfähigere Methoden zur Identifizierung und Validierung von Protein-Protein-Interaktionen, zuletzt LuTHy, eine Double-Readout-Lumineszenz-basierte Technologie zur Interaktomkartierung in Säugetierzellen (Trepte et al., Mol Syst Biol, 2018). Eine neue Ressource zur Kartierung des Interaktoms der Neurodegeneration steht der Forschung seit 2020 zur Verfügung (Haenig et al., Cell Rep., 2020):
https://www.mdc-berlin.de/de/news/news/verdaechtige-unbekannte